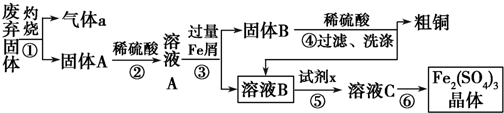
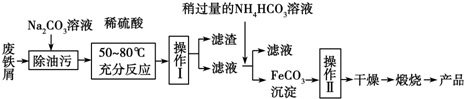
题目内容
10.质量为2.3g含有一种金属杂质的金属钠,放入足量的稀硫酸中反应,得到氢气0.09g,则所含的金属杂质可能是( )| A. | K | B. | Mg | C. | Al | D. | Cu |
分析 2.3g钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,0.1mol钠与稀硫酸反应生成0.05mol氢气,质量为2g/mol×0.05mol=0.1g>0.09g,说明等质量的杂质与稀硫酸反应生成氢气的量比钠小,据此进行解答.
解答 解:2.3g钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,根据电子守恒,0.1mol钠与稀硫酸反应生成氢气为:$\frac{0.1mol}{2}$=0.05mol,质量为:2g/mol×0.05mol=0.1g>0.09g,说明等质量的杂质与稀硫酸反应生成氢气的量比钠小,
A.2.3gK与稀硫酸反应生成氢气的质量为:2g/mol×$\frac{2.3g}{39g/mol}$×$\frac{1}{2}$≈0.059g<0.1g,满足条件,故A正确;
B.2.3gMg与稀硫酸反应生成氢气的质量为:2g/mol×$\frac{2.3g}{24g/mol}$≈0.19g>0.1g,不满足条件,故B错误;
C.2.3g铝与稀硫酸反应生成氢气的质量为:2g/mol×$\frac{2.3g}{27g/mol}$×$\frac{3}{2}$≈0.26g>0.1g,不满足条件,故C错误;
D.铜不与稀硫酸反应,若钠中含有杂质铜,生成氢气的质量减小,满足条件,故D正确;
故选AD.
点评 本题考查了化学方程式的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
20.如图,将铜片、锌片用导线连接后置于同一稀硫酸中形成原电池,下列相关叙述正确的是( )


| A. | 锌片是原电池负极 | B. | 铜片质量逐渐减少 | ||
| C. | H+在负极得到电子被还原 | D. | 电流从锌片经导线流向铜片 |
1.下列盐的水溶液中,呈碱性的是( )
| A. | KCl | B. | NH4Cl | C. | Na2CO3 | D. | KNO3 |
18.CuS 与HNO3反应后的产物为CuSO4、NO和H2O,下列说法正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为 8﹕3 | |
| B. | 氧化剂与还原剂的物质的量之比为 3﹕8 | |
| C. | 若有 1 mol NO 气体生成,转移的电子总数为 6 mol | |
| D. | 反应的离子方程式为 CuS+2H++2NO3-═Cu2++2NO↑+SO42-+H2O |
5.下列关于Na+的叙述错误的是( )
| A. | 在空气中很稳定 | B. | 焰色反应显黄色 | ||
| C. | 与水反应放出氢气 | D. | 半径比钠原子小 |
2.火药是中国的“四大”发明,由KNO3和两种非金属元素A和B的单质组成,A为黑色固体,B为淡黄色的固体,则下列有关说法中不正确的是( )
| A. | 元素A与N和O同周期,B与O同主族 | |
| B. | A、B分别与O组成的化合物AO和BO2均是大气的污染物 | |
| C. | A和B分别与O组成的化合物均能与烧碱反应 | |
| D. | 单质A在一定条件下可与B的最高价氧化物的水化物发生反应 |
19.化学与社会、科学、技术、环境和生活有密切关系.下列说法不正确的是( )
| A. | 含氮、磷的污水任意排放会污染水体,导致水华、赤潮等 | |
| B. | 油脂能增加食物的滋味,增进食欲,保证机体的正常生理功能 | |
| C. | 利用高纯单质硅的半导体性能,可以制成光电池 | |
| D. | 纤维素和淀粉是同分异构体,在人体内均可水解成葡萄糖为人体提供能量 |