题目内容
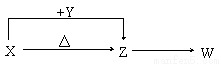
在同温同压下,同体积的甲烷(CH4)和二氧化碳的原子总数之比为 ,质量之比为 。
5:3 4:11
【解析】
试题解析:同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3,甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11。
考点:阿伏伽德罗定律及推论

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案(12分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
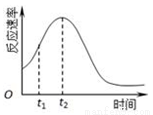
(1)该实验探究的是 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: < (填实验序号)研究发现反应速率总是如图所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,② 。
(3)若实验①在4 min末收集了4.48 mL CO2(标准状况),则4 min末c(MnO4-)= mol·L-1(假设溶液混合后体积为50 mL),此4 min内的平均速率为v(H2C2O4)= 。
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定 来比较化学反应速率。
(7分)化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0。反应物A的浓度(mol·L-1)随时间(min)的变化情况如下表:
实验序号 | 温度 | 0 min | 10 min | 20 min | 30min | 40min | 50 min | 60min |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
2 | 800℃ | c2 | 0.6 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.6 | 0.6 | 0.6 |
4 | 820℃ | 1.0 | 0.4 | 0.25 | 02 | 0.2 | 02 | 02 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10min至20min时间内v(A)的平均速率为 mol·L-1·min-l
(2)在实验2中A的初始浓度为 mol·L-1,由实验2的数据,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为vl,则v3 (填“>”、“<”或“=”) vl 。且c3 (填“>”、“<”或“=”)1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应是 (填“吸热”或“放热”)反应,
 xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,下列说法正确的是