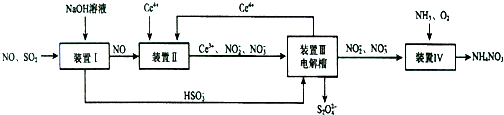
题目内容
 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5minZ的平均反应速率为
(3)5min后Z的生成速率比5min末Z的生成速率
考点:反应速率的定量表示方法
专题:
分析:(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据公式v=
来计算;
(3)化学平衡状态的标志:正逆反应速率相等.
(2)根据公式v=
| △c |
| △t |
(3)化学平衡状态的标志:正逆反应速率相等.
解答:
解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.6mol:0.2mol:0.4mol=3:1:2,则反应的化学方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应开始至2min时的平均反应速率为:
=0.05mol/(L?min),5min时Z的平均反应速率v=
=
=0.04mol?(L?min)-1,
故答案为:0.05mol?(L?min)-1;0.04mol?(L?min)-1;
(3)5min时,化学反应达到了平衡状态,正逆反应速率相等,故答案为:相等.
故答案为:3X+Y?2Z;
(2)反应开始至2min时的平均反应速率为:
| ||
| 2min |
| △c |
| △t |
| ||
| 5min |
故答案为:0.05mol?(L?min)-1;0.04mol?(L?min)-1;
(3)5min时,化学反应达到了平衡状态,正逆反应速率相等,故答案为:相等.
点评:本题考查化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法和化学平衡状态的标志是关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
可逆反应:mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其他条件不变时,C 的体积分数(C%)与温度T和压强P的 关系如图.下列叙述正确的是( )


| A、达到平衡后,加入催化剂C%增大 |
| B、达到平衡后,若升温平衡向左移 |
| C、m+n<e+f |
| D、达平衡后,若降压平衡向左移动 |
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为( )
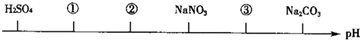
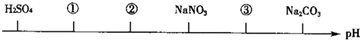
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
已知某反应的焓变小于零,则下列叙述正确的是( )
| A、该反应是放热反应 |
| B、该反应是吸热反应 |
| C、该反应中反应物总能量小于生成物总能量 |
| D、无法确定该反应的热效应 |
下列反应的离子方程式正确的是( )
| A、将SO2通入氯水中:SO2+Cl2+H2O=2H++SO42-+2Cl- |
| B、氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
| C、硅酸钠溶液中通入CO2气体:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
| D、碳酸氢钠和稀硫酸反应:CO3-+2H+═CO2↑+H2O |
 向0.01mol的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
向0.01mol的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示: