题目内容
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
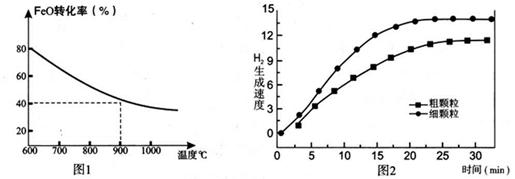
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
H2O(g)+3FeO(s)
 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)2Fe3O4(s)
 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。

(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。

(16分)(1)(2a+b)kJ/mol(2分)(无kJ/mol或“2a+b kJ/mol”扣1分,其他不给分)
(2)用廉价的清洁能源供给热能(2分)(答用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能给3分;答“加热”、“升高温度”等均不给分)
(3)①细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(3分) (“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等合理表述给3分;答“增大反应物浓度”、“FeO的量增加,反应速率加快”给1分); ②相等(2分)(答“等于”、“=”给1分)
③(4分)解:900℃时,达到平衡时FeO转化的量为:n(FeO)=0.60mol×40%=0.24mol
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080 (2分)
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K= =
= =
=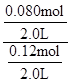 =0.67(2分)
=0.67(2分)
(4)(3分)
(2)用廉价的清洁能源供给热能(2分)(答用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能给3分;答“加热”、“升高温度”等均不给分)
(3)①细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(3分) (“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等合理表述给3分;答“增大反应物浓度”、“FeO的量增加,反应速率加快”给1分); ②相等(2分)(答“等于”、“=”给1分)
③(4分)解:900℃时,达到平衡时FeO转化的量为:n(FeO)=0.60mol×40%=0.24mol
H2O(g)+3FeO(s)
 Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080 (2分)
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K=
 =
= =
=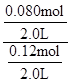 =0.67(2分)
=0.67(2分)(4)(3分)

试题分析:(1)先对已知热化学方程式编号为①②,观察发现①×2+②可得,2H2O(g)=2H2(g)+O2(g),其焓变=①的焓变×2+②的焓变=(2a+b)kJ/mol;(2)b>0,说明反应II是吸热反应,可用用廉价的清洁能源供给热能或用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能;(3)①FeO是反应I中的固体反应物,细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(或“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等);②由于固体物质浓度是常数,FeO的用量和浓度保持不变,将粗颗粒FeO改为细颗粒FeO,只能加快反应速率,不能使平衡移动,因此H2O(g)的平衡转化率不变或相等;③解:900℃时,达到平衡时FeO转化的物质的量量为:n(FeO)=0.60mol×40%=0.24mol,则:
H2O(g)+3FeO(s)
 Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K=
 =
= =
= =0.67;
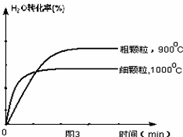
=0.67;(4)观察图1可得:随着温度的升高,FeO的平衡转化率减小,前者导致平衡向吸热方向移动,后者说明平衡向逆反应方向移动,因此逆反应是吸热反应,则反应I的正反应是放热反应;其他条件保持不变时,900℃→1000℃就是升高温度,既能加快反应速率,又能使平衡向逆反应方向移动,则H2O(g)的转化率由0逐渐增大,知道达到平衡,1000℃时达到平衡的时间比900℃时少,1000℃时H2O(g)的平衡转化率比900℃时小,由此可以画出水蒸气的转化率随温度变化的示意图。

练习册系列答案
相关题目
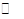 H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1

 。
。 催化还原
催化还原 的方法也可以消除氮氧化物的污染。例如:
的方法也可以消除氮氧化物的污染。例如: CH3OH(g)
CH3OH(g)

 2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
 2CO(g) △H1;
2CO(g) △H1; 4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
4CO(g)+4H2O(g) △H=-1038kJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):


 4CO2(g) + 2H2O(l) + 2600 kJ
4CO2(g) + 2H2O(l) + 2600 kJ