题目内容
7.下列各组物质的性质比较中,正确的是( )| A. | 稳定性:HCl>H2S>H2O | B. | 熔、沸点HF>HCl>HBr | ||
| C. | 熔、沸点KCl<MgO<MCl2 | D. | 熔、沸点CH4<SiH4<GeH4 |
分析 A.元素非金属性越强,气态氢化物越稳定;
B.分子晶体中,气态氢化物的熔沸点与其相对分子质量成正比,但氢键影响氢化物的熔沸点;
C.离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高;
D.分子晶体中,气态氢化物的熔沸点与其相对分子质量成正比.
解答 解:A.因为非金属性O>Cl>S,所以稳定性:H2O>HCl>H2S,故A错误;
B.分子晶体中,气态氢化物的熔沸点与其相对分子质量成正比,但氢键影响氢化物的熔沸点,所以熔、沸点HF>HBr>HCl,故B错误;
C.离子半径Mg2+<O2-<K+<Cl-,离子电荷数K+=Cl-<O2-=Mg2+,离子晶体的离子半径越小,带电荷数越多,晶格能越大,则晶体的熔沸点越高,因此熔、沸点MgO>MgCl2>KCl,故C错误;
D.分子晶体中,气态氢化物的熔沸点与其相对分子质量成正比,所以熔、沸点CH4<SiH4<GeH4,故D正确;
故选D.
点评 本题主要考查了非金属性、熔沸点的大小比较,掌握相关物质的化学键、分子间作用力与熔沸点的关系是解答的关键,题目难度不大.

练习册系列答案
相关题目
17.化学与数学有密切的联系,将某些化学知识用数轴表示,可以受到直观形象、简明易记的良好效果.下列用数轴表示的化学知识中错误的是( )
| A. | 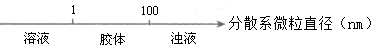 分散系的分类 | |
| B. | 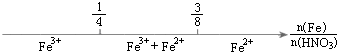 铁与稀硝酸反应后溶液中铁元素的存在形式 | |
| C. | 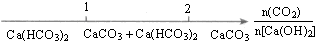 CO2通入澄清石灰水中反应的产物 | |
| D. | 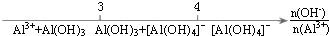 AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 |
12.下列实验中,对应的现象及结论都正确且存在因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
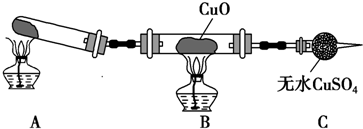
| A | 用酒精灯加热摩尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中的白色粉末先变成天蓝色,后又变成深蓝色 | 加热温度较低时摩尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 向CuSO4溶液中通入H2S气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
| D | 将干燥的氯气通入放有鲜花的瓶中 | 鲜花褪色 | 说明氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法中正确的一组是( )
| A. |  和 和 互为同分异构体 互为同分异构体 | |
| B. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| C. | 金刚石、石墨和“足球烯”C60为同素异形体 | |
| D. | H2和D2互为同位素 |
16.下列物质属于由共价键形成的化合物的是( )
| A. | H2 | B. | CaCl2 | C. | C2H6 | D. | KF |