题目内容
下列有关元素周期律的叙述中,正确的是( )
| A、酸性强弱:H3PO4<H2SO4 |
| B、金属性强弱:K<Na |
| C、氧化性强弱:F2<Cl2 |
| D、碱性强弱:NaOH<Mg(OH)2 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.非金属性越强,最高价氧化物的水化物的酸性越强;
D.同主族,原子序数大的金属性强;
C.非金属性越强,对应单质的氧化性越强;
D.金属性越强,最高价氧化物的水化物的碱性越强.
D.同主族,原子序数大的金属性强;
C.非金属性越强,对应单质的氧化性越强;
D.金属性越强,最高价氧化物的水化物的碱性越强.
解答:
解:A.非金属性S>P,最高价氧化物的水化物的酸性为H3PO4<H2SO4,故A正确;
D.K、Na同主族,原子序数大的金属性强,金属性强弱:K>Na,故B错误;
C.非金属性F>Cl,对应单质的氧化性为F2>Cl2,故C错误;
D.金属性Na>Mg,最高价氧化物的水化物的碱性为NaOH>Mg(OH)2,故D错误;
故选A.
D.K、Na同主族,原子序数大的金属性强,金属性强弱:K>Na,故B错误;
C.非金属性F>Cl,对应单质的氧化性为F2>Cl2,故C错误;
D.金属性Na>Mg,最高价氧化物的水化物的碱性为NaOH>Mg(OH)2,故D错误;
故选A.
点评:本题考查元素性质的比较,为高频考点,把握元素的金属性、非金属性比较为解答的关键,注意元素的位置及元素周期律的应用,C为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在8NH3+3Cl2═6NH4Cl+N2反应中,若有10.2g氨气被氧化,则反应用去的氯气在标准状况下体积为( )
| A、5.04L |
| B、6.72L |
| C、20.16L |
| D、40.32L |
25℃0.12mol?L-1的NaOH溶液和0.10mol?L-1盐酸等体积混合后,溶液的pH为( )(假设混合后溶液体积可以直接相加)
| A、pH=2 | B、pH=10 |
| C、pH=12 | D、pH=13 |
下列说法正确的是( )
| A、经加热发生的反应都是吸热反应 |
| B、放热反应不需要加热就能进行 |
| C、反应物的总能量高于生成物的总能量的反应属于放热反应 |
| D、上述都不对 |
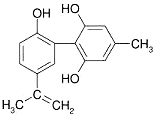 “人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )
“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )| A、该分子中的碳原子均为不饱和碳原子 |
| B、滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质分别与浓溴水和H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| D、遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物 |
日常生活的下列变化中只有物理变化的是( )
| A、粮食酿酒 | B、米饭变馊 |
| C、铁锅生锈 | D、冰融化成水 |
鉴别苯酚、苯、环己烯、四氯化碳、乙醇、碘化钠溶液,应选用的一种试剂是( )
| A、稀盐酸 |
| B、FeCl3溶液 |
| C、浓溴水 |
| D、酸性高锰酸钾溶液 |
等物质的量浓度的下列五种溶液,①CH3COOH ②(NH4)2CO3③NaHSO4④NaHCO3⑤Ba(OH)2,溶液中水的电离程度由大到小排列正确的是( )
| A、⑤③①④② |
| B、③⑤①②④ |
| C、②④③①⑤ |
| D、②④①③⑤ |