题目内容
1.在FeCl3和CuCl2混合液中,两者物质的量之比2:7,加入过量铁屑W1g,反应完全后,剩余固体质量为W2,则W1与W2的关系为( )| A. | W1=W2 | B. | W1>W2 | C. | W1<W2 | D. | 无法确定 |
分析 在FeCl3和CuCl2混合液中两者物质的量之比2:7,设原溶液中有2xmol FeCl3,7 xmol CuCl2,发生反应为2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,分别利用差量法计算出反应中固体增加与减少的质量,根据计算结果进行判断.
解答 解:在FeCl3和CuCl2混合液中两者物质的量之比2:7,设原溶液中有2xmol FeCl3,7 xmol CuCl2,则:
2Fe3++Fe═3Fe2+ 固体减少质量△m1
2mol 56 g
2xmol 56x
Cu2++Fe═Fe2++Cu 固体增加质量△m2
1mol 8 g
7x mol 56x g
根据分析可知,固体减少与增加的质量相等,即W1=W2,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,试题侧重考查学生分析计算能力,注意利用差量法进行解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
11.下列五种有机物存在如图所示的转化关系,下列说法正确的是( )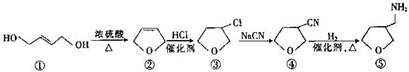

| A. | 有机物①与乙烯互为同系物 | |
| B. | 有机物③转化为有机物④的反应属于加成反应 | |
| C. | 有机物④转化为有机物⑤的反应中反应物的物质的量之比为1:1 | |
| D. | 含有一个四元环,且能与金属钠反应的有机物③的同分异构体(不考虑立体异构)有3种 |
12.有关仪器的零刻度说法正确的是( )
| A. | 量筒的“0”在下方 | B. | 滴定管的“0”在上方 | ||
| C. | 移液管的“0”在尖嘴处 | D. | 托盘天平的“0”在刻度盘的中央 |
6.核电荷数为16的元素原子和核电荷数为4的元素原子相比较,前者的下列数据不是后者的4倍的是( )
| A. | 电子层数 | B. | 质子数 | C. | 电子数 | D. | 次外层电子数 |
13.下列不属于烃的衍生物的是( )
| A. | C8H16 | B. | C3H7Cl | C. | CH2═CH-CH2OH | D. | CH3CHO |
11.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 14 g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1 molN2与4 molH2反应生成的NH3分子数为2NA | |
| C. | 铜-锌(稀硫酸)原电池,每转移数2NA电子则正极消耗1 mol铜 | |
| D. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA |
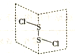 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示.
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示.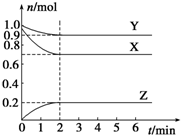 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: