题目内容
16.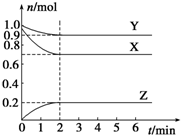 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+Y?2Z.
(2)反应开始至2min,气体Z的反应速率为0.05mol/(L.min)此时的体系压强是开始时的0.9倍
(3)若反应容器体积可变,则充入氦气会使反应速率变慢(填变快、变慢或不变)
(4)在2L的另一个密闭容器中,放入0.2mol A和0.3mol B,在一定温度下,压强为p,放入催化剂(体积忽略),发生反应2A(g)+3B(g)?xC(g)+2D(g),在a min后,容器中c(A)=0.05mol•L-1,若温度不变,压强变为0.9p,则v(C)==$\frac{1}{20a}$mol•L-1•min-1.
分析 根据图象知,随着反应进行,X、Y的物质的量减少而Z物质的量增大,说明X、Y是反应物而Z是生成物,
(1)达到平衡状态时,参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,同一反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,据此书写方程式;
(2)Z的平均反应速率=$\frac{\frac{△n}{V}}{△t}$;恒温恒容条件下,气体的物质的量之比等于其压强之比;
(3)若反应容器体积可变,则充入氦气,体积膨胀,气体浓度减小,会使反应速率减小;
(4)2A(g)+3B(g)?xC(g)+2D
初起:0.2mol 0.3mol 0 0
变化:0.1 0.15 0.05x 0.1
a min后:0.05×2 0.15 0.05x 0.1
则:$\frac{0.2+0.3}{0.1+0.15+0.05x+0.1}=\frac{1}{0.9}$,所以x=2,根据v(C)=$\frac{\frac{0.05×2}{2}}{a}$mol•L-1•min-1,由此解答.
解答 解:根据图象知,随着反应进行,X、Y的物质的量减少而Z物质的量增大,说明X、Y是反应物而Z是生成物,
(1)达到平衡状态时,参加反应的△n(X)=(1.0-0.7)mol=0.3mol、△n(Y)=(1.0-0.9)mol=0.1mol、△n(Z)=(0.2-0)mol=0.2mol,同一反应中同一时间段内参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.3mol:0.1mol:0.2mol=3:1:2,所以该反应方程式为3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)Z的平均反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.2}{2}}{2}$=0.05mol/(L.min),根据图象知,未反应时混合气体的物质的量=(1.0+1.0)mol=2.0mol,平衡状态混合气体物质的量=(0.9+0.7+0.2)mol=1.8mol,恒温恒容条件下,气体的物质的量之比等于其压强之比,所以平衡状态体系压强是开始时的$\frac{1.8mol}{2.0mol}$=0.9倍,
故答案为:0.05mol/(L.min);0.9;
(3)若反应容器体积可变,则充入氦气,体积膨胀,气体浓度减小,会使反应速率减小,故答案为:变慢;
(4)2A(g)+3B(g)?xC(g)+2D
初起:0.2mol 0.3mol 0 0
变化:0.1 0.15 0.05x 0.1
a min后:0.05×2 0.15 0.05x 0.1
则:$\frac{0.2+0.3}{0.1+0.15+0.05x+0.1}=\frac{1}{0.9}$,所以x=2,根据v(C)=$\frac{\frac{0.05×2}{2}}{a}$mol•L-1•min-1=$\frac{1}{20a}$mol•L-1•min-1,故答案为:$\frac{1}{20a}$mol•L-1•min-1.
点评 本题考查图象分析,侧重考查学生分析及计算能力,明确曲线变化趋势含义、物质的量变化量与其计量数的关系即可解答,难点是(4)题计算,题目难度中等.


下列说法正确的是( )
| A. | X、Y和Z中均不含手性碳原子 | |
| B. | Y能发生氧化、还原、取代、消去反应 | |
| C. | 一定条件下,1 mol X最多能与5 mol H2发生加成反应 | |
| D. | 1 mol Z最多可与含3 mol NaOH的溶液反应 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 8种 |
| A. | H-OH | B. | CH3OH | C. | C6H5OH | D. | C2H5OCH2OH |
| A. | W1=W2 | B. | W1>W2 | C. | W1<W2 | D. | 无法确定 |
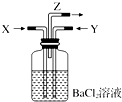 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )| A. | 在Z导管出来的气体中一定有二氧化碳 | |
| B. | 洗气瓶中产生的沉淀是碳酸钡 | |
| C. | 洗气瓶中产生的沉淀是亚硫酸钡和碳酸钡 | |
| D. | 在Z导管的出口处会有无色气体出现 |
| A. | 22.4L的H2和CO2混合气体中含有的分子总数为NA | |
| B. | 常温常压下,24g金属镁变为镁离子时得到的电子数为2NA | |
| C. | 标准状况下,5.6LO2和O3的混合气体含有的原子数为0.5NA | |
| D. | 1 mol Cl2与足量Fe反应,转移的电子数为2NA |