题目内容
9.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 标准状况下,2.24L Cl2通入足量水中或NaOH溶液中,转移的电子数均为0.1NA. | |
| B. | 1mol CnH2n含有的共用电子对数为(3n+1)NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子书为0.2NA | |
| D. | 2gD2160中含中子、质子、电子数目均为NA |
分析 A、氯气和水的反应可逆反应;
B、CnH2n中含3n条共价键;
C、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属;
D、求出重水的物质的量,然后根据1mol重水中含中子数、电子数和质子数均为10个来分析.
解答 解:A、氯气和水的反应可逆反应,不能进行彻底,故标况下2.24L即0.1mol氯气和水反应转移的电子数小于0.1NA个,故A错误;
B、CnH2n中含3n条共价键,故1mol中含共用电子对数为3nNA个,故B错误;
C、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属,故当阳极质量减少6.4g时,转移的电子数大于0.2NA个,故C错误;
D、2g重水的物质的量为0.1mol,而1mol重水中含中子数、电子数和质子数均为10个,故0.1mol重水中含电子数、中子数和中子数均为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 第二周期元素的正化合价由+1→+7依次升高 | |
| B. | PH3在空气中可以自燃,根据元素周期律可以推知SiH4很难燃烧 | |
| C. | Cl的非金属性强于S,所以HClO3的酸性一定强于H2SO3 | |
| D. | Li的电子层数小于Al,但是Li的原子半径却却大于Al |
14.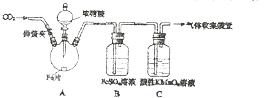 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
 甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.
甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物.文献记载:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,气生成的产物有有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0
Ⅲ.NO2和NO都能被KMnO4氧化吸收
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | / |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余 |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是取少量反应后A中溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口.若试纸变蓝,则A中生成NH4+.
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅(或绿),无色气体逸出,且在空气中变为红棕色.甲依据该现象得出的结论是A中有NO生成.请用化学平衡原料解释原因:FeSO4+NO?Fe(NO)SO4(棕色)△H<0正反应放热,加热后,平衡向逆反应方向移动.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是浓硝酸换成稀硝酸,此时A中首先发生反应的离子方程式是Fe+4H++NO3-═Fe3++NO↑+2H2O,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)cd.
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液.
1.丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中正确的是( )
①新制氯水久置后→浅黄绿色消失 ②Cl2通入石蕊试液中→先变红后褪色 ③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去 ⑤氨气通入酚酞溶液中→红色 ⑥N2和O2放电条件下→直接生成红棕色气体.
①新制氯水久置后→浅黄绿色消失 ②Cl2通入石蕊试液中→先变红后褪色 ③SO2通入石蕊试液中→先变红后褪色 ④SO2通入品红溶液中→红色褪去 ⑤氨气通入酚酞溶液中→红色 ⑥N2和O2放电条件下→直接生成红棕色气体.
| A. | ①②③⑥ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
19.短周期元素H、X、Y、Z在周期表中的相对位置如图所示.已知X的最高正价和最低负价的代数和为0,下列推断正确的是( )
| X | Y | ||
| H | Z |
| A. | 常温下,含H的两种离子都能使水电离出的c•(H+)•c(OH-)增大 | |
| B. | Y的简单氢化物和Y的最高价含氧酸之间能发生氧化还原反应 | |
| C. | X的气态氢化物的热稳定性比Y的气态氢化物的热稳定性强 | |
| D. | 简单离子半径的大小顺序为H>Z>Y |
 为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用.
为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用. ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.
,Ni能与CO形成正四面体形的配合物Ni(CO)4,1molNi(CO)4中含有σ键的数目为8NA.