题目内容
17.某元素的一种同位素离子Xm-的质量数为A,含b个电子,它与重氢原子D组成DmX分子,则ag DmX分子中含中子的物质的量是$\frac{a}{A+2m}$(A-b+2m)mol.分析 根据核内质子数=核外核外电子数-电荷数,中子数=质量数-质子数,计算X原子中子数,进而计算每个DmX分子含有中子数,根据n=$\frac{m}{M}$计算DmX的物质的量,结合每个分子含有中子数计算.
解答 解:某元素的一种同位素离子Xm-的质量数为A,核内质子数=b-m,则中子数为(A-b+m),则每个DmX分子含有中子数为(A-b+m+m),ag HmX的物质的量为$\frac{ag}{(A+2m)g/mol}$=$\frac{a}{A+2m}$mol,故含有中子物质的量为$\frac{a}{A+2m}$(A-b+2m)mol;
故答案为:$\frac{a}{A+2m}$(A-b+2m).
点评 本题主要考查了质子数、中子数、质量数、核外电子数之间的关系,难度不大,把握阴离子中核外电子数的计算方法是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.与0H?具有相同质子数和电子数的粒子是( )
| A. | F? | B. | C1? | C. | NH3 | D. | H2O |
5.有两种气态烷烃的混合物,在标准状况下密度为1.16g•L-1,则关于此混合物组成的说法正确的是( )
| A. | 一定有乙烷 | B. | 一定有丙烷 | ||
| C. | 可能是乙烷和丙烷的混合物 | D. | 可能是甲烷和丁烷的混合物 |
9.分析下列各项结构的规律,按此规律排布第8项的分子式应为( )
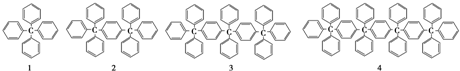

| A. | C158H118 | B. | C158H116 | C. | C160H116 | D. | C160H118 |
6.短周期元素A、B、C在元素周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
| A | C | |
| B |
| A. | A、B、C三元素的气态氢化物溶于水均显酸性 | |
| B. | A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | C在周期表中的位置为第二周期第ⅦA族,最高价为+7价 | |
| D. | B02是酸性氧化物,AO2不是酸性氧化物 |
7.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| C. | 6.4g铜与足量的硫磺在绝隔空气的条件下反应,电子转移的数目为0.1NA | |
| D. | 1mol白磷分子中所含共价键数为4NA |

 .
.