题目内容
将盐酸溶液逐滴滴入NaOH、NaAlO2、Na2CO3的混合溶液中,下列图象能正确表示溶液中反应的是
- A.

- B.

- C.

- D.

分析:首先发生反应H++OH-=H2O,开始不产生沉淀,氢氧化钠反应完毕,再发生反应AlO2-+H++H2O═Al(OH)3↓,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,最后发生反应Al(OH)3+3H+═Al3++3H2O,由方程式可知,生成氢氧化铝沉淀与氢氧化铝沉淀完全溶解消耗的盐酸的体积之比为1:3,据此结合选项判断.
解答:首先发生反应H++OH-=H2O,开始不产生沉淀,氢氧化钠反应完毕,再发生反应AlO2-+H++H2O═Al(OH)3↓,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,最后发生反应Al(OH)3+3H+═Al3++3H2O,由方程式可知,生成氢氧化铝沉淀与氢氧化铝沉淀完全溶解消耗的盐酸的体积之比为1:3,沉淀与加入盐酸溶液体积关系图为:
 ,
,A、沉淀达最大值时滴加盐酸,沉淀量不立即减少,故A错误;
B、加入盐酸,开始不能产生沉淀,沉淀达最大值时滴加盐酸,沉淀量不立即减少,故B错误;
C、由以上分析可知,图象与实际相符合,故C正确;
D、加入盐酸,开始不能产生沉淀,故D错误;
故选C.
点评:考查离子反应与图象关系、化学计算等,难度中等,清楚离子反应的先后顺序是解题的关键.

 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案完成下列计算:
(1)将4.6g金属钠投入100克水中,充分反应.已知:2Na+2H2O→2NaOH+H2↑
①生成标准状况下氢气
②求反应后溶液中NaOH的质量分数
(2)将10g CO和CO2的混合气体,通过装有足量过氧化钠的干燥管,反应后干燥管的总质量增加了5.6g.
已知:2Na2O2+2CO2→2Na2CO3+O2,求原混合气体中CO2的质量分数.计算过程:
(3)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O→Na2CO3?nH2O(n为平均值,n≤10).
取没有妥善保管已部分变质的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表.(不计溶于水的CO2气体)
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
Na2CO3+HCl→NaHCO3+NaCl NaHCO3+HCl→NaCl+CO2↑+H2O
试求:
①滴入稀盐酸的物质的量浓度为:
②当加入盐酸后,生成CO2体积不再增加时,x的最小值为
③部分变质后样品A中:NaHCO3的物质的量;Na2CO3?nH2O的物质的量以及n值.计算过程:
(15分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA |
| 0 | |||||
| 1 |
| ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
| ① | ⑧ | ② |
|
|
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
|
|
|
(1)②、④、⑤的原子半径由大到小的顺序为____________________。
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3) ②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是 (填名称),用原子结构知识解释 ,可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为____________ _________,
(15分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ① | ⑧ | ② | | |
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | | | |
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3)②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是 (填名称),用原子结构知识解释 ,可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
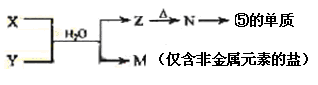
X溶液与Y溶液反应的离子方程式为____________ _________,
(15分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
① |
⑧ |
② |
|
|
|
3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
|
|
(1)②、④、⑤的原子半径由大到小的顺序为____________________。
②、④、⑤的离子半径由大到小的顺序为____________________。
(2)①②⑥⑦四种元素所对应的气态氢化物最稳定的是________,最不稳定的是_____(填化学式)。
(3) ②、③可形成既含离子键又含共价键的化合物,其阳离子和阴离子的个数比为_____。
(4)③、⑤两元素最高价氧化物对应水化物发生反应的离子方程式为__________________________。
(5)工业上用①单质大量生产⑥单质,反应的化学方程式为_______________________________。
(6)④⑤两元素相比较,金属性较强的是 (填名称),用原子结构知识解释 ,可以验证该结论的实验是 (填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)分别往氯化镁溶液、氯化铝溶液中逐滴滴入氢氧化钠溶液直到过量。
(7)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为____________ _________,



