题目内容
比较等物质的量浓度的:①H2SO3;②NaHSO3;③Na2SO3.三种溶液中c(SO32-)浓度的大小,排列正确的是( )
| A、①>②>③ |
| B、③>②>① |
| C、②>①>③ |
| D、③>①>② |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:基本概念与基本理论
分析:先根据n=cV计算溶质的物质的量,再根据溶质的电离和水解分析带电微粒的多少.
解答:
解:三种溶液中亚硫酸钠是强电解质,可以完全电离出亚硫酸根离子.所以③中的亚硫酸根离子浓度最大.而②亚硫酸氢钠电离出亚硫酸氢根离子,再由亚硫酸氢根离子电离出亚硫酸根离子,这一步电离是类似弱电解质电离,比较微弱,产生的亚硫酸根离子浓度比较小.至于①中的亚硫酸,只有在分步电离的第二步电离时才会产生亚硫酸根离子,第二步电离本身很微弱,几乎可以忽略不计.
故选B.
故选B.
点评:本题考查了溶液中带电微粒多少的判断,难度较大,注意:强酸弱碱盐或强碱弱酸在水中以电离为主,水解是微弱的.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下列物质属于天然高分子化合物的是( )
| A、聚乙烯 | B、合成橡胶 |
| C、油脂 | D、纤维素 |
下列有关分类的说法正确的是( )
| A、CH3CH(CH3)2属于链状化合物 |
B、 属于芳香族化合物 属于芳香族化合物 |
C、 属于脂环化合物 属于脂环化合物 |
D、 属于醇类化合物. 属于醇类化合物. |
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g)△H<0.现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
| B、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| D、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |

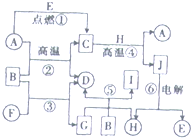 物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:
物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题: