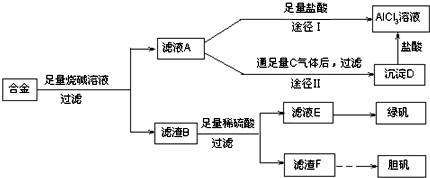
��Ŀ����
��ҵ���Ի�ͭ����Ҫ�ɷ���CuFeS2�����ʲ�����ˮ���ᣩΪԭ�ϣ��Ʊ���ɫ����G���仯ѧʽΪ[Cu��NH3��4]SO4?H2O���漰�������£�

��֪25��ʱ�����ֽ�������������ܶȻ���������ȫ������pH��Χ���±���
��1���ӿ��ͭ�������ʣ��ɲ��õĴ�ʩ�� ��д���֣���
��2������˫��ˮ���ܷ�����Ӧ�����ӷ���ʽΪ ���Լ�X�Ļ�ѧʽΪ ��
��3�������£�0.1mol/L�Լ�Y��pH=11������¶��£��Լ�Y�ĵ��볣��Ϊ ����pH��ֽ�����ҺpHֵ�ķ����� ��
��4����֪Cu��OH��2+4NH3?H2O?[Cu��NH3��4]2++2OH+4H2O��д���÷�Ӧ��ƽ�ⳣ������ʽ�� ��
��5������ҺN�м����Ҵ���Ŀ���� ��

��֪25��ʱ�����ֽ�������������ܶȻ���������ȫ������pH��Χ���±���
| Fe��OH��2 | Cu��OH��2 | Fe��OH��3 | |
| Ksp | 8.0��1016 | 2.2��1022 | 4.0��1038 |
| ��ȫ����pH | ��9.6 | ��6.4 | ��3.2 |
��2������˫��ˮ���ܷ�����Ӧ�����ӷ���ʽΪ
��3�������£�0.1mol/L�Լ�Y��pH=11������¶��£��Լ�Y�ĵ��볣��Ϊ
��4����֪Cu��OH��2+4NH3?H2O?[Cu��NH3��4]2++2OH+4H2O��д���÷�Ӧ��ƽ�ⳣ������ʽ��
��5������ҺN�м����Ҵ���Ŀ����
���㣺���ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ��
ר�⣺ʵ�������
���������̷�����ͭ������������Cu2S��FeS�Ͷ���������Cu2S��FeS��������������Һ�ܽ���壬�õ���Һ�к���Cu2+��Fe2+�������������������������Ϊ�����ӣ���������Լ�CuO������ҺPHʹ����ȫ��������ͭ���Ӳ���������������Լ�YΪһˮ�ϰ�����Ӧ����ͭ�������Ϊ��ɫ��Һ�������Ҵ���Ŀ���ǽ������ܽ�ȣ������ھ���������
��1����ͭ���ڷ���¯�б���ʱ��������Ӧ������Cu2S��FeS������Ӱ�컯ѧ��Ӧ���ʵ����ط����жϣ�
��2�������ݿ�����ȥ��Ԫ�أ�Ӧ��+2����ת��Ϊ+3����������˫��ˮ�ɴﵽ��Ŀ�ģ�Fe3+ˮ��������Cu2+ǿ��Fe3++3H2O?Fe��OH��3+3H+����������ͭ��������ͭ��̼��ͭ���ʽ̼��ͭ���������ɵ��ᣬ��ʹFe3+��ȫˮ�⣬���˳�ȥ������CuO�������������ɣ�
��3���ɵ��볣������ʽ����ɵã�����pH��ֽ��ʹ�÷����ش�
��4������ƽ�ⳣ��������д������������ͭ��ˮ��д�����ʽ��
��5������ɫ�������Ҫ�ɷ���[Cu��NH3��4]SO4?H2O�������Ҵ���Ŀ���ǽ������ܽ�ȣ��ٽ�����������
��1����ͭ���ڷ���¯�б���ʱ��������Ӧ������Cu2S��FeS������Ӱ�컯ѧ��Ӧ���ʵ����ط����жϣ�
��2�������ݿ�����ȥ��Ԫ�أ�Ӧ��+2����ת��Ϊ+3����������˫��ˮ�ɴﵽ��Ŀ�ģ�Fe3+ˮ��������Cu2+ǿ��Fe3++3H2O?Fe��OH��3+3H+����������ͭ��������ͭ��̼��ͭ���ʽ̼��ͭ���������ɵ��ᣬ��ʹFe3+��ȫˮ�⣬���˳�ȥ������CuO�������������ɣ�
��3���ɵ��볣������ʽ����ɵã�����pH��ֽ��ʹ�÷����ش�
��4������ƽ�ⳣ��������д������������ͭ��ˮ��д�����ʽ��
��5������ɫ�������Ҫ�ɷ���[Cu��NH3��4]SO4?H2O�������Ҵ���Ŀ���ǽ������ܽ�ȣ��ٽ�����������
���
�⣺��1����ͭ���ڷ���¯�б���ʱ��������Ӧ������Cu2S��FeS������ʽΪ2CuFeS2+O2�TCu2S+2FeS+SO2���ӿ췴Ӧ���ʵ����ؿ��Ƿ����ͭ���������ʵĽӴ��������Ӧ���ʣ������¶ȼӿ췴Ӧ���ʣ�������������٣�����Ӧ���Ũ������Ӧ���ʣ�
�ʴ�Ϊ������ͭ����飬�����¶ȣ�����������٣�
��2�������ݿ�����ȥ��Ԫ�أ�Ӧ��+2����ת��Ϊ+3����������˫��ˮ�ɴﵽ��Ŀ�ģ���Ӧ�����ӷ���ʽΪ��2Fe2++2H++H2O=2Fe3++2H2O�������Լ�X��Ϊ�˽�����Һ�����ԣ��ʿ��Լ���CuO��Cu��OH��2�������ԣ�
�ʴ�Ϊ��2Fe2++2H++H2O=2Fe3++2H2O��CuO��
��3���Լ�Y�ǰ�ˮ��0.1 mol/LʱpH=11��c��OH-����c��NH4+��=10-3��NH3?H2O�ĵ��볣��ΪK=
=
=10-5��
��pH��ֽ�����ҺpHֵ�ķ����ǣ�ȡһСƬpH��ֽ���ڲ���Ƭ��������ϣ��ýྻ�IJ�����պȡ����Һ����pH��ֽ�����룬�����ɫ����ɫ��ȡpHֵ��
�ʴ�Ϊ��10-5��ȡһСƬpH��ֽ���ڲ���Ƭ��������ϣ��ýྻ�IJ�����պȡ����Һ����pH��ֽ�����룬�����ɫ����ɫ��ȡpHֵ��
��4����֪Cu��OH��2+4NH3?H2O?[Cu��NH3��4]2++2OH+4H2O��д���÷�Ӧ��ƽ�ⳣ������ʽΪ��K=
��
�ʴ�Ϊ��
��
��5������ɫ�������Ҫ�ɷ���[Cu��NH3��4]SO4?H2O�������Ҵ���Ŀ���ǽ������ܽ�ȣ������ھ����������ʴ�Ϊ�����پ����ܽ�ȣ������ھ���������
�ʴ�Ϊ������ͭ����飬�����¶ȣ�����������٣�
��2�������ݿ�����ȥ��Ԫ�أ�Ӧ��+2����ת��Ϊ+3����������˫��ˮ�ɴﵽ��Ŀ�ģ���Ӧ�����ӷ���ʽΪ��2Fe2++2H++H2O=2Fe3++2H2O�������Լ�X��Ϊ�˽�����Һ�����ԣ��ʿ��Լ���CuO��Cu��OH��2�������ԣ�
�ʴ�Ϊ��2Fe2++2H++H2O=2Fe3++2H2O��CuO��
��3���Լ�Y�ǰ�ˮ��0.1 mol/LʱpH=11��c��OH-����c��NH4+��=10-3��NH3?H2O�ĵ��볣��ΪK=
| c(NH4+)c(Cl-) |
| c(NH3?H2O) |
| 10-3��10-3 |
| 0.1 |
��pH��ֽ�����ҺpHֵ�ķ����ǣ�ȡһСƬpH��ֽ���ڲ���Ƭ��������ϣ��ýྻ�IJ�����պȡ����Һ����pH��ֽ�����룬�����ɫ����ɫ��ȡpHֵ��
�ʴ�Ϊ��10-5��ȡһСƬpH��ֽ���ڲ���Ƭ��������ϣ��ýྻ�IJ�����պȡ����Һ����pH��ֽ�����룬�����ɫ����ɫ��ȡpHֵ��
��4����֪Cu��OH��2+4NH3?H2O?[Cu��NH3��4]2++2OH+4H2O��д���÷�Ӧ��ƽ�ⳣ������ʽΪ��K=
| c2(OH-)c(Cu(NH3)42+) |
| c4(NH3?H2O) |
�ʴ�Ϊ��
| c2(OH-)c(Cu(NH3)42+) |
| c4(NH3?H2O) |
��5������ɫ�������Ҫ�ɷ���[Cu��NH3��4]SO4?H2O�������Ҵ���Ŀ���ǽ������ܽ�ȣ������ھ����������ʴ�Ϊ�����پ����ܽ�ȣ������ھ���������
�����������Թ�������Ϊ�����������˻�ѧʵ�����������������ԭ���ۡ���ѧƽ�����۵����֪ʶ����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�
�����Ŀ
 ����������Ԫ��X��Y��Z��W��ԭ��������������X��Y��Zԭ������֮����W��2����X��Z�����ڱ��е����λ����ͼ��ʾ��X������۾���ֵ����ԭ��������������ȣ�����˵������ȷ���ǣ�������
����������Ԫ��X��Y��Z��W��ԭ��������������X��Y��Zԭ������֮����W��2����X��Z�����ڱ��е����λ����ͼ��ʾ��X������۾���ֵ����ԭ��������������ȣ�����˵������ȷ���ǣ�������| A��ԭ�Ӱ뾶��Y��Z��W |
| B��һ�������£�Y���û���X |
| C����̬�⻯���ȶ��ԣ�Z��W |
| D���۵�YW2��XW4 |
��������ʵ��װ���������Ӧʵ����ǣ�������

| A��װ�âٲⶨ��ѧ��Ӧ���� |
| B��װ�â���ȡ������HCl |
| C��װ�â���ȡ8.5mL��ϡ���� |
| D��װ�â�ģ�����ĸ�ʴ |
��4.6g�������ܽ���95.4gˮ�У�������Һ���ʵ����������ǣ�������
| A������7.8% |
| B������8% |
| C������ 8% |
| D���� 7.8% |
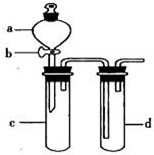 ij��ȤС����Ƴ���ͼ��ʾװ�����Ľ��̲��С�ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ����
ij��ȤС����Ƴ���ͼ��ʾװ�����Ľ��̲��С�ͭ�����ᷴӦ��ʵ�飬��̽����ѧʵ�����ɫ����