题目内容
1.在0℃1.01×105Pa下,有关H2、N2、O2三种气体的叙述正确的是( )| A. | 其密度之比等于物质的量之比 | |
| B. | 其密度之比等于摩尔质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量之比 | |
| D. | 等体积的三种气体,其物质的量之比等于相对分子质量之比 |
分析 相同条件下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$、V=$\frac{m}{M}{V}_{m}$、n=$\frac{V}{{V}_{m}}$进行计算,据此分析解答.
解答 解:相同条件下,气体摩尔体积相等,
A.根据ρ=$\frac{M}{{V}_{m}}$知,气体摩尔体积相等时,其密度之比等于摩尔质量之比,与物质的量无关,故A错误;
B.根据A知,气体密度之比等于其摩尔质量之比,故B正确;
C.根据V=$\frac{m}{M}{V}_{m}$知,相同质量时其体积之比等于摩尔质量反比,故C错误;
D.根据n=$\frac{V}{{V}_{m}}$,相同体积时,其物质的量相等,与相对分子质量无关,故D错误;
故选B.
点评 本题考查阿伏伽德罗定律及其推论,为高频考点,明确物质的量公式中各个物理量之间关系是解本题关键,注意气体摩尔体积适用范围及适用条件,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某一元强酸稀溶液和某一元弱碱稀溶液等体积混合后,溶液pH等于7.0,则以下叙述正确的是( )
| A. | 酸溶液的物质的量浓度大于碱溶液的物质的量浓度 | |
| B. | 酸溶液中H+的浓度小于碱溶液中0H-的浓度 | |
| C. | 酸和碱混合时,碱过量 | |
| D. | 酸溶液的pH与碱溶液pH之和为14 |
12. 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
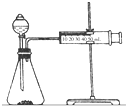
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
9.在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | Fe2+、NO3-、I-、Cl- |
16.下列关于氧化钠和过氧化钠的叙述正确的是( )
| A. | Na2O2和Na2O都是白色固体,都能与冷水作用得到O2和NaOH | |
| B. | 在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 | |
| C. | 相同物质的量的氧化钠和过氧化钠中阴离子物质的量之比为1:1 | |
| D. | Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物 |
6.设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温常压下,16gS03中含有的分子数为0.2NA | |
| B. | 常温下,30gSiO2晶体中含有Si--O键的数目为NA | |
| C. | 标准状况下,2.2 LCl2与足量水反应转移的电子数为0.1NA | |
| D. | 标准状况下,92.4 LNO与11.2LO2混合后所含分子数为NA |
13.80g密度为ρg.cm-3的CaCl2溶液里含2gCa2+,从中再取出一半的溶液中Cl-的浓度是( )
| A. | $\frac{ρ}{800}$mol•L-1 | B. | 1.25ρmol•L-1 | C. | $\frac{ρ}{1600}$mol•L-1 | D. | 0.63mol•L-1 |
11.下列描述正确的是( )
| A. | 乙烷中若混有乙烯,可通过酸性高锰酸钾溶液除去 | |
| B. | 乙醇中是否混有水,可用加入金属钠是否产生气体进行检验 | |
| C. | 蚕丝和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检测 |
 电化学原理在工业生产中有重要应用.如图1所示电解池中:
电化学原理在工业生产中有重要应用.如图1所示电解池中: