题目内容
13. 如图所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:
如图所示,实验室用NH4Cl和Ca(OH)2制取NH3.试回答下列问题:(1)收集氨气的方法是向下排空气法;氨气的水溶液显碱性;
(2)若有1.5mol氯化铵参加反应,则产生的氨气在标准状况下的体积为33.6L.
分析 (1)依据氨气易溶于水,密度小于空气密度,氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子和铵根离子;
(2)根据氯化铵和氨气的关系式计算氨气的体积.
解答 解:(1)氨气易溶于水,密度小于空气密度,应选择向下排空气法收集;氨气与水反应生成一水合氨,一水合氨电离生成氢氧根离子和铵根离子,溶液显碱性;
故答案为:向下排空气;碱;
(2)设生成氨气的体积是VL
2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
2mol 44.8L
1.5mol VL
V=33.6L
故答案为:33.6.
点评 本题考查了氨气的制备和有关方程式的计算,明确氨气制备原理和性质是解题关键,题目难度不大.

练习册系列答案
相关题目
3.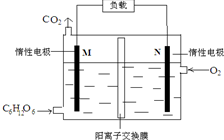 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
 一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )
一种新型污水处理装置模拟细胞内生物电的产生过程,可将酸性有机废水的化学能直接转化为电能,下列说法中不正确的是( )| A. | 与等量的C6H12O6完全燃烧放热比较,该装置发电效率高 | |
| B. | 若用该电池电解氧化铝制铝,与N极相连的电极有气体生成 | |
| C. | 电子流向:M→负载→N→电解质溶液→M | |
| D. | 当N极消耗5.6L(标况下)气体时,最多有NA个H+通过阳离子交换膜 |
1.下列过程中,化学平衡不发生移动的是( )
| A. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液颜色变深 | |
| C. | 红棕色的NO2加压后颜色先变深后逐渐变浅 | |
| D. | 向氯水中加入适量石灰石,氯水的杀菌能力增强 |
5.汽车尾气中的有害物质NO和CO能缓慢起反应,2CO+2NO═N2+2CO2,为了控制大气污染,某同学提出了下列建议,你认为可行的方法是( )
| A. | 改变汽车尾气排放压强 | |
| B. | 提高反应温度 | |
| C. | 在尾气排放处使用催化剂 | |
| D. | 向汽车发动机燃烧室中通入过量的空气 |
2.利用下列实验装置完成相应的实验,能达到实验目的是( )
| A. |  称量NaOH固体 | B. |  用酒精提取溴水中的溴 | ||
| C. |  除去水中的氯化钠 | D. |  从Y进气收集Cl2 |
3.下列各组有机物,只用括号中的一种试剂无法鉴别的是( )
| A. | 乙醇、甲苯、硝基苯(水) | |
| B. | 苯、甲苯、环己烷(酸性高锰酸钾溶液) | |
| C. | 苯、苯酚、己烯(浓溴水) | |
| D. | 甲酸、乙醛、乙酸(新制的氢氧化铜悬浊液) |
