题目内容
根据下列实验操作和现象,所得的实验结论正确的是( )
| 实验操作及现象 | 实验结论 | |
| A | 向2mL 0.1mol?L-1 CH3COOH溶液中滴加等浓度的NaHCO3溶液,有气泡产生 | 酸性: CH3COOH>H2CO3 |
| B | 向2mL 0.1mol?L-1 NaOH溶液中滴加3滴0.1mol?L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol?L-1 FeCl3溶液,出现红褐色沉淀 | 溶度积: Mg(OH)2>Fe(OH)3 |
| C | 在少量无水乙醇中加入金属Na,生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| D | 用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4,又迅速产生较多气泡 | H2SO4浓度增大,反应速率加快 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.发生强酸制取弱酸的反应;
B.NaOH溶液过量,发生沉淀的生成;
C.少量无水乙醇中加入金属Na,生成氢气,但乙醇不能电离;
D.足量Zn反应,3mL稀H2SO4溶液完全反应生成少量氢气,然后加浓硫酸,Zn再与硫酸反应生成氢气,不能体现对比性.
B.NaOH溶液过量,发生沉淀的生成;
C.少量无水乙醇中加入金属Na,生成氢气,但乙醇不能电离;
D.足量Zn反应,3mL稀H2SO4溶液完全反应生成少量氢气,然后加浓硫酸,Zn再与硫酸反应生成氢气,不能体现对比性.
解答:
解:A.2mL 0.1mol?L-1 CH3COOH溶液中滴加等浓度的NaHCO3溶液,有气泡产生,发生强酸制取弱酸的反应,则酸性为CH3COOH>H2CO3,故A正确;
B.NaOH溶液过量,发生沉淀的生成,而不发生沉淀的转化,则不能比较溶度积大小,故B错误;
C.少量无水乙醇中加入金属Na,生成氢气,氢气能燃烧,但乙醇不能电离,则CH3CH2OH是非电解质,故C错误;
D.足量Zn反应,3mL稀H2SO4溶液完全反应生成少量氢气,然后加浓硫酸,Zn再与硫酸反应生成氢气,不能体现对比性,则不能说明浓度对反应速率的影响,故D错误;
故选A.
B.NaOH溶液过量,发生沉淀的生成,而不发生沉淀的转化,则不能比较溶度积大小,故B错误;
C.少量无水乙醇中加入金属Na,生成氢气,氢气能燃烧,但乙醇不能电离,则CH3CH2OH是非电解质,故C错误;
D.足量Zn反应,3mL稀H2SO4溶液完全反应生成少量氢气,然后加浓硫酸,Zn再与硫酸反应生成氢气,不能体现对比性,则不能说明浓度对反应速率的影响,故D错误;
故选A.
点评:本题考查化学实验方案的评价,为高频考点,涉及酸性比较、沉淀的生成及转化、电解质判断、影响反应速率的因素等,侧重化学反应原理及实验分析能力的考查,注意实验的评价性、操作性分析,题目难度中等.

练习册系列答案
相关题目
将a g Fe、Mg合金溶解在一定量的稀硝酸中,当合金完全溶解后,收集到标准状况下的NO气体b L(设HNO3的还原产物只有NO),再向反应后的溶液中加入足量NaOH溶液,得到沉淀物.若用守恒法求沉淀的质量,用到的守恒关系依次是( )
| A、质量守恒、电子守恒、电荷守恒 |
| B、电子守恒、质量守恒、电荷守恒 |
| C、电子守恒、电荷守恒、质量守恒 |
| D、电荷守恒、质量守恒、电子守恒 |
在氧化还原反应中,下列叙述正确的是( )
| A、物质失电子的反应为还原反应 |
| B、物质在变化中得到电子,此物质是还原剂 |
| C、发生电子转移的反应即是氧化还原反应 |
| D、发生化合价升降的反应一定是氧化还原反应 |
化学与社会生活密切相关,下列说法正确的是( )
| A、PM2.5是指空气中直径≤2.5μm的颗粒物,直径为2.5μm的颗粒物分散在空气中形成胶体(1μm=10-6m) |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 |
| D、亚硝酸钠是有毒物质,不能添加到食物中 |
下列说法正确的是( )
| A、农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
| B、羊毛、过氧化氢酶、牛胰岛素、血红蛋白、人造奶油充分水解均可得到氨基酸 |
| C、石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向 |
| D、多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5口罩等都是治理“雾霾”等灾害性天气的有效措施 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、32g O2气体含有的氧原子数为NA |
| B、2L 0.3mol/L Na2SO4溶液中含有Na+为0.6NA |
| C、27g铝完全反应后失去的电子数为3NA |
| D、11.2L氮气所含的分子数为0.5NA |
关于下列物质的说法,正确的是( )


| A、三者含有的官能团的种类相同 |
| B、乙和丙中的-OH性质相同 |
| C、甲和乙互为同分异构体 |
| D、甲和丙互为同分异构体 |
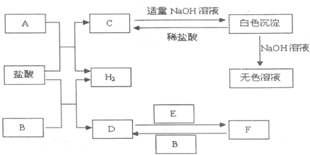 下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.