题目内容
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g);△H
(1)已知,该反应在300℃,5MPa条件下能自发进行,则△H
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示.
①在0~2min内,以H2表示的平均反应速率为
②列式计算300℃时该反应的平衡常数K=
③300℃时,将0.50mol CO、1.00mol H2和1.00mol CH3OH充入容积为2L的密闭容器中,此时反应将
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图.
考点:反应热和焓变,化学平衡的影响因素,化学平衡的调控作用
专题:化学反应中的能量变化,化学平衡专题
分析:(1)当△H-T△S<0时,反应自发进行,结合方程式分析即可;
(2)①据图分析出△c和△t即可求出;α(CO)=
代入数值即可;
②利用三段式法解答;
③据该温度下的K和Qc比较,当K>Qc时平衡正向移动,K<Qc时平衡逆向移动;
④结合影响平衡移动的因素,使平衡正向移动即可;
(3)结合影响反应速率和影响平衡移动的因素解答.
(2)①据图分析出△c和△t即可求出;α(CO)=
| c(CO)反应的 |
| c(CO)加入的 |
②利用三段式法解答;
③据该温度下的K和Qc比较,当K>Qc时平衡正向移动,K<Qc时平衡逆向移动;
④结合影响平衡移动的因素,使平衡正向移动即可;
(3)结合影响反应速率和影响平衡移动的因素解答.
解答:
(1)该反应的反应物有3mol气体,生成物有1mol气体,所以△S<0,反应自发进行△H-T△S<0,故△H必须小于0,故答案为:<;<;
(2)①2min时,甲醇浓度变化0.02mol/L,则氢气浓度变化为0.04mol/L,v(H2)=
=
=0.02mol/(L?min)-1
从图象分析,生成甲醇0.04mol,则反应的CO为0.04mol,α(CO)=
×100%=20%,
故答案为:0.02;20%;
②CO(g)+2H2(g)?CH3OH(g)
加入的(mol/L) 0.10 0.29 0
反应的(mol/L) 0.02 0.04 0.02
平衡后(mol/L) 0.08 0.25 0.02
K=
=
=4(mol/L)-2
故答案为:K=
=
=4(mol/L)-2;
③Qc=K=
=
=8>K=4,所以平衡逆向移动,选B,
故答案为:K=
=
=4(mol/L)-2; B;
④A、对于反应CO(g)+2H2(g)?CH3OH(g),反应物气体体积大于生成物,压缩容器体积 时,压强增大,平衡正向移动,可增加甲醇产率,A正确;
B、分离出甲醇,平衡正向移动可增加甲醇产率,故B正确;
C、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故C错误;
D、体积不变,再充入反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选:A B D;
(3)温度升高,反应速率加快,达到平衡时间短.正反应放热,升温时平衡逆向移动,平衡时甲醇浓度比300℃低,可得下图: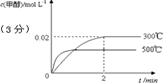
故答案为: .
.
(2)①2min时,甲醇浓度变化0.02mol/L,则氢气浓度变化为0.04mol/L,v(H2)=
| △c(H2) |
| △t |
| 0.04mol/L |
| 2min |
从图象分析,生成甲醇0.04mol,则反应的CO为0.04mol,α(CO)=
| 0.04mol |
| 0.20mol |
故答案为:0.02;20%;
②CO(g)+2H2(g)?CH3OH(g)
加入的(mol/L) 0.10 0.29 0
反应的(mol/L) 0.02 0.04 0.02
平衡后(mol/L) 0.08 0.25 0.02
K=
| c(CHOH) |
| c(CO)?c2(H2) |
| 0.02mol/L |
| 0.08mol/L×0.25mol/L2 |
故答案为:K=
| c(CHOH) |
| c(CO)?c2(H2) |
| 0.02mol/L |
| 0.08mol/L×0.25mol/L2 |
③Qc=K=
| c(CHOH) |
| c(CO)?c2(H2) |
| 0.50 |
| 0.25×0.502 |
故答案为:K=
| c(CHOH) |
| c(CO)?c2(H2) |
| 0.02mol/L |
| 0.08mol/L×0.25mol/L2 |
④A、对于反应CO(g)+2H2(g)?CH3OH(g),反应物气体体积大于生成物,压缩容器体积 时,压强增大,平衡正向移动,可增加甲醇产率,A正确;
B、分离出甲醇,平衡正向移动可增加甲醇产率,故B正确;
C、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故C错误;
D、体积不变,再充入反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选:A B D;
(3)温度升高,反应速率加快,达到平衡时间短.正反应放热,升温时平衡逆向移动,平衡时甲醇浓度比300℃低,可得下图:

故答案为:
 .
.
点评:本题考查范围广,有一定难度,需要细心认真完成.适合现在的高考复习.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
不能用金属跟盐酸反应直接得到的盐是( )
| A、AlCl3 |
| B、FeCl3 |
| C、MgCl2 |
| D、ZnCl2 |
用电动公交车初步替代燃油公交车是天津市节能减排、控制雾霾的重要举措之一.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe,有关该电池的下列说法中,正确的是( )
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
下列过程需加入还原剂才能实现的是( )
| A、KMnO4→MnO2 |
| B、HSO3-→SO2 |
| C、Cu2+→Cu |
| D、I-→I2 |

 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题: 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.