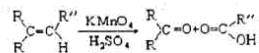题目内容
14.6-羰基庚酸是一种重要的化工中间体,其合成路线如图: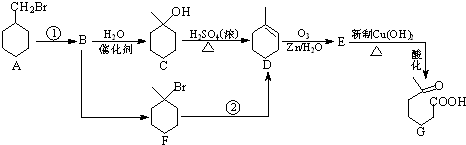
已知:

(1)反应①的试剂与条件是NaOH的醇溶液、加热;
(2)下列说法中正确的是cd;
a.C能被催化氧化成酮
b.D不能使酸性高锰酸钾溶液褪色
c.Ni催化下1mol E最多可与2molH2加成
d.G既能发生取代反应,又能发生加成反应
(3)E与新制Cu(OH)2反应的化学方程式为
 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O;(4)G的同分异构体有多种,满足以下条件的同分异构体有4种.
a.分子中含有环己烷的结构
b.能与NaHCO3溶液反应,放出气体
c.1mol该物质能与2molNa完全反应
(5)已知“Diels-Alder反应”为:
 物质D与呋喃(
物质D与呋喃( )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为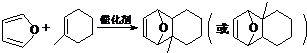 .
.
分析 由合成流程图可知,A→B为消去反应,B为CH2= ,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为
,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为 ,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,然后结合有机物的结构和性质来解答.
,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,然后结合有机物的结构和性质来解答.
解答 解:由合成流程图可知,A→B为消去反应,B为CH2= ,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为
,B→C为与水的加成反应,C→D为消去反应,结合信息可知,D→E发生氧化反应,且E与新制Cu(OH)2反应,则E为 ,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,
,E→G发生氧化反应,B→F为与HBr发生的加成反应,F→D为卤代烃的消去反应,
(1)由上述分析可知反应①为卤代烃的消去反应,则反应条件为NaOH的醇溶液、加热,
故答案为:NaOH的醇溶液、加热;
(2)a.因C中与-OH相连的碳原子上没有H,则C不能被催化氧化成酮,故a错误;
b.D中有碳碳双键,能使酸性高锰酸钾溶液褪色,故b错误;
c.E为 ,Ni催化下1mol E最多可与2molH2加成,故c正确;
,Ni催化下1mol E最多可与2molH2加成,故c正确;
d.G有羰基能发生加成反应,有羧基能发生取代反应,故d正确;
故选cd;
(3)E与新制Cu(OH)2的化学方程式为为 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O,
+Cu2O↓+3H2O,
故答案为: +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
(4)a.分子中含有环己烷的结构;
b.能与NaHCO3溶液反应,放出气体,说明含有羧基;
c.1mol该物质能与2molNa完全反应,说明该分子中还含有1个羟基,
羧基和羟基位于不同碳上有3种,位于同一个碳原子上有1种;
所以符合条件的有4种;
故答案为:4;
(5)由信息可知,物质D与呋喃的反应为 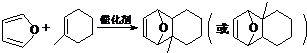 ,
,
故答案为: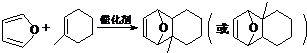 .
.
点评 本题考查有机物的合成,注意利用合成流程图中物质的结构及官能团的变化来分析发生的反应及物质的性质,同分异构体的书写为解答的难点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 盐酸 | B. | 氯水 | C. | 烧碱溶液 | D. | 浓硫酸 |
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀,有气泡产生 | ||
| C. | 有铁生成 | D. | 无变化 |
| A. | 高纯度的单晶硅用于制造光导纤维 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 乙酸乙酯在碱性条件下水解称为皂化反应 | |
| D. | 可溶性铜盐有毒,在生命体中铜是一种不可缺少的微量元素 |
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72-+8H++3SO32-═2Cr3+(绿色)+3SO42-+4H2O.下列分析正确的是( )
| A. | CrO42-和S2-在酸性溶液中可大量共存 | |
| B. | 实验②说明氧化性:Cr2O72->SO42- | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| A. | 有单质参加的化合反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
①乙烯 ②乙烷 ③乙苯 ④乙醇 ⑤乙酸 ⑥聚乙烯 ⑦苯.
| A. | ①③⑥ | B. | ③⑤⑥⑦ | C. | ①③④ | D. | ②⑤⑦ |
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;