题目内容
10.下列离子方程式书写正确的是( )| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 氯气与水的反应:Cl2+H2O=2H++Cl-+ClO- | |
| C. | 铜片跟稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 铝片和氢氧化钠溶液反应:Al+OH-+6H2O=[Al(OH)4]-+3H2↑ |
分析 A.碳酸氢钙与过量氢氧化钠溶液反应生成碳酸钙、碳酸钠和水;
B.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
C.铜与稀硝酸反应生成的是NO气体;
D.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒.
解答 解:A.碳酸氢钙溶液中加入过量的氢氧化钠溶液,反应生成碳酸钙、碳酸钠和水,反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故A正确;
B.氯气与水的反应生成氯化氢和次氯酸,正确的离子方程式为:Cl2+H2O=H++Cl-+HClO-,故B错误;
C.铜片跟稀硝酸反应生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故C错误;
D.铝片和氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
20.现有部分元素的性质与原子(或分子)结构如下表:
(1)X形成的双原子分子的结构式为O=O,X形成的氢化物的沸点在同族元素形成的氢化物中是最高(填“最高”或“最低”),原因是水分子间存在氢键
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
(4)1mol单质Zn与 2mol Z元素形成的强酸浓溶液反应生成的气体是SO2,如何检验产生的气体产物用品红检验,如品红褪色,且加热溶液变红
(5)单质W与有机物CH3CH(OH)COOH反应的化学方程式为2Na+CH3CH(OH)COOH→CH3CH(ONa)COONa+H2↑,.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
(4)1mol单质Zn与 2mol Z元素形成的强酸浓溶液反应生成的气体是SO2,如何检验产生的气体产物用品红检验,如品红褪色,且加热溶液变红
(5)单质W与有机物CH3CH(OH)COOH反应的化学方程式为2Na+CH3CH(OH)COOH→CH3CH(ONa)COONa+H2↑,.
18.根据反应式:(1)Br2+2I-=2Br-+I2 (2)Cl2+2Br-=Br2+2Cl-可判断离子的氧化性由强到弱的顺序是( )
| A. | Cl2、Br2、I2 | B. | Br2、Cl2、I2 | C. | I2、Cl2、Br2 | D. | I2、Br2、Cl2 |
5.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
15.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到得现象.
(4)结论
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{2}$的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为1mol/L.
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到得现象.
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为2Fe2++Br2=2Fe3++2Br-.
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有$\frac{1}{2}$的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为1mol/L.
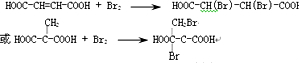
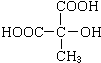 .
.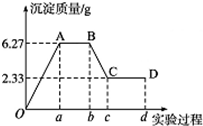 下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示:
下面是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag +、Ca2+、Cl-、CO32-和SO42-中的若干种,该小组同学取100mL水样进行实验:向样品中先滴加硝酸钡溶液,再滴加1.0mol•L-1的硝酸,实验过程中沉淀质量的变化如图所示: