题目内容
写出电离方程式
(1)CaCO3
(2)NH3?H2O
(3)某次降雨中的硫酸的浓度为5×10-7mol/L,则它的PH= .
(1)CaCO3
(2)NH3?H2O
(3)某次降雨中的硫酸的浓度为5×10-7mol/L,则它的PH=
考点:电离方程式的书写,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)碳酸钙为强电解质,完全电离出钙离子和碳酸根离子;
(2)一水合氨为弱电解质,部分电离出铵根离子和氢氧根离子;
(3)硫酸为二元强酸,完全电离,根据pH=-lgc(H+)计算;
(2)一水合氨为弱电解质,部分电离出铵根离子和氢氧根离子;
(3)硫酸为二元强酸,完全电离,根据pH=-lgc(H+)计算;
解答:
解:(1)碳酸钙为强电解质,完全电离CaCO3=Ca2++CO32-,故答案为:CaCO3=Ca2++CO32-;
(2)NH3?H2O为弱电解质,部分电离,电离方程式为NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-;
(3)H2SO4是强电解质,能完全电离,电离方程式为:H2SO4=2H++SO42-,硫酸的浓度为5×10-7mol/L,则c(H+)=1×10-6mol/L,pH=-lgc(H+)=6,故答案为:6.
(2)NH3?H2O为弱电解质,部分电离,电离方程式为NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-;
(3)H2SO4是强电解质,能完全电离,电离方程式为:H2SO4=2H++SO42-,硫酸的浓度为5×10-7mol/L,则c(H+)=1×10-6mol/L,pH=-lgc(H+)=6,故答案为:6.
点评:本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
下列描述,其因果关系成立的是( )
| A、因为NH3的水溶液可以导电,所以NH3是电解质 |
| B、因为SO2可以使溴水褪色,所以SO2具有漂白性 |
| C、因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH |
| D、因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应 |
天然气和液化石油气(主要成分为C3~C8的烷烃)燃烧的化学方程式分别是:CH4+2O2
CO2+2H2O,C3H8+5O2
3CO2+4H2O.现有一套以天然气为燃料的灶具,欲改烧液化石油气,应采用的正确措施是( )
| 点燃 |
| 点燃 |
| A、减小空气进入量,减小石油气进入量 |
| B、增大空气进入量或减小石油气进入量 |
| C、增大空气进入量,增大石油气进入量 |
| D、减小空气进入量或增大石油气进入量 |
下列离子方程式书写正确的是( )
| A、在100 mL 1 mol?L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、在100 mL 2 mol?L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- |
| C、向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、常温常压下,48gO3含有的氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为NA |
| C、物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为NA |
| D、标准状况下,11.2 L氧气所含的原子数为NA |
下列化学方程式中,可以用离子方程式 H++OH-═H2O表示的是( )
| A、3HCl+Fe(OH)3═FeCl3+3H2O |
| B、HNO3+KOH═KNO3+H2O |
| C、H2SO4+Ba(OH)2═BaSO4↓+2H2O |
| D、2HCl+Cu(OH)2═CuCl2+2H2O |
下列做法中不符合“绿色化学”思想的是( )
| A、以水性涂料代替油性涂料 |
| B、以无磷洗涤剂代替含磷洗涤剂 |
| C、实验后的有毒有害物质应分类收集、统一处理 |
| D、在通风橱中制氯气时不用NaOH溶液吸收尾气 |
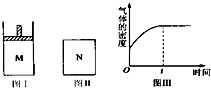 在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol B,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4,下列判断不正确的是( )
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a mol A和a mol B,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4,下列判断不正确的是( )| A、x=4 |
| B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态 |
| C、若A为气体,B为非气体,则平衡时M、N中C的物质的量相等 |
| D、若A、B均为气体,平衡时M中A的转化率大于N中A的转化率 |
 的有机物分子中:在同一直线上的碳原子最多有
的有机物分子中:在同一直线上的碳原子最多有