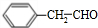题目内容
6. 如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体,在标准状况下为2.24L.下列说法正确的是( )
如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体,在标准状况下为2.24L.下列说法正确的是( )| A. | 一段时间后A池溶液pH升高,B池中c(Cu2+)减小 | |
| B. | d、e两极都发生氧化反应 | |
| C. | e极应为粗铜板材料 | |
| D. | B池中f极质量减小12.8 g |
分析 A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L,则d电极上生成氧气,d为阳极,则c、e是阴极而f是阳极.
A.A池电解氢氧化钠实质是电解水,溶剂减少,溶质不变,碱的浓度增大;B池中精炼铜,电解质溶液中铜离子浓度略减小;
B.阴极上得电子发生还原反应,阳极上失电子发生氧化反应;
C.电解精炼时,粗铜作阳极、纯铜作阴极;
D.根据转移电子守恒计算e增重的质量,而f是粗铜含铁镍等金属,在电解过程中也会失去电子溶解,所以阳极f减小的质量并不等于阴极增重的质量.
解答 解:A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L,则d电极上生成氧气,d为阳极,则c、e是阴极而f是阳极.
A.A池电解氢氧化钠实质是电解水,溶剂减少,溶质不变,碱的浓度增大,碱性增强,PH值增大;B池中精炼铜,电解质溶液中铜离子浓度略减小,故A正确;
B.阴极上得电子发生还原反应,阳极上失电子发生氧化反应,d是阳极、e是阴极,所以d发生氧化反应、e发生还原反应,故B错误;
C.电解精炼时,粗铜作阳极、纯铜作阴极,e是阴极、f是阳极,所以e是纯铜、f是粗铜,故C错误;
D.d电极上生成的气体是氧气,其物质的量为0.1mol,根据转移电子守恒得e生成m(Cu)=$\frac{0.1mol×4}{2}$×64g/mol=12.8g,则e极增重12.8g,f是粗铜含铁镍等金属,在电解过程中也会失去电子溶解,所以阳极f减小的质量不等于阴极增重的质量,故D错误;
故选A.
点评 本题考查电解原理,为高频考点,正确判断阴阳极及各个电极上发生的反应是解本题关键,注意结合转移电子守恒分析解答,题目难度不大.

| A. | CS2的电子式为: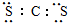 | B. | Ca2+的离子结构示意图为: | ||
| C. | HClO的结构式为:H-O-Cl | D. | 氯化铵的电子式为: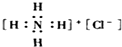 |
| A. | 乙烯的结构简式:CH2 CH2 | |
| B. | 硫离子结构示意图: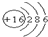 | |
| C. | CaF2的电子式: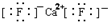 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe23++3SO42- |

下列说法正确的是( )
| A. | X与Y互为同分异构体 | |
| B. | 1mol X最多可以与5mol H2发生加成反应 | |
| C. | 产物Y能发生氧化、加成、取代、消去反应 | |
| D. | 1 molY最多能与2mol NaOH发生反应 |
| A. | BaCl2溶液 | B. | 稀硝酸和BaCl2溶液 | ||
| C. | 稀硫酸和BaCl2溶液 | D. | 稀盐酸和BaCl2溶液 |
| A. | 1:1:1:1 | B. | 1:2:2:1 | C. | 1:1:2:3 | D. | 1:2:2:3 |
| A. | 1.0L1.0mol•L-1CH3COOH溶液中,CH3COOH分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| C. | 标准状况下,22.4L甲醇完全燃烧后生成的CO2分子数目约为NA | |
| D. | 2.8 g乙烯和丁烯的混合气体中所含碳原子数为0.2NA |

 +n HOCH2CH2OH$→_{△}^{浓硫酸}$
+n HOCH2CH2OH$→_{△}^{浓硫酸}$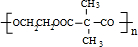 +2n H2O
+2n H2O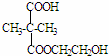 ;
;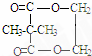 ;
;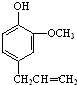 ,F是丁子香酚的一种同分异构体,常用于合成药物的中间体,可以通过以下方案合成.A是一种气态烃.密度是同温同压时氢气的14倍.
,F是丁子香酚的一种同分异构体,常用于合成药物的中间体,可以通过以下方案合成.A是一种气态烃.密度是同温同压时氢气的14倍.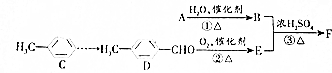
 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$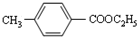 +H2O;
+H2O;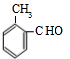 、
、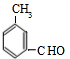 、
、