题目内容
14.向100mL 0.5mol/L的Na2CO3溶液中加人-定体积1mol/L的盐酸,恰好完全反应.试计算:(1)加入盐酸的体积;
(2)反应生成气体的体积(标准状况);
(3)假设反应前后溶液体积不变,求所得溶液中Na+的物质的量浓度;
(4)将1L 0.5mol/L的Na2CO3溶液稀释为0.1mol/L,所得溶液的体积是多少升?
分析 先根据n=cV计算出碳酸钠溶液中碳酸钠的物质的量,再根据反应方程式计算出消耗的盐酸的物质的量、生成二氧化碳的物质的量,
(1)根据V=$\frac{n}{c}$计算出加入盐酸的体积;
(2)根据V=nmol×22.4L/mol计算出生成的二氧化碳在标况下的体积;
(3)根据c=$\frac{n}{{V}_{总}}$计算出反应后溶液中钠离子的物质的量浓度;
(4)根据c(浓)•V(浓)=c(稀)•V(稀)计算.
解答 解:100mL 0.5mol•L-1的Na2CO3溶液中碳酸钠的物质的量为:n(Na2CO3)=0.1L×0.5 mol•L-1=0.05mol,
设加入盐酸的物质的量为x mol,生成气体的物质的量为y mol
Na2CO3 +2HCl=2NaCl+CO2↑+H2O
1 mol 2mol 1 mol
0.05mol x y
则:1mol×x=2mol×0.05mol,解得x=0.1mol,
1mol×y=1mol×0.05mol,解得y=0.05mol,
(1)加入的盐酸的体积为:$\frac{0.1mol}{1mol/L}$=0.1L=100mL,
答:加入盐酸的体积为100mL;
(2)反应生成的二氧化碳的体积(标况下)为:22.4L/mol×0.05mol=1.12L=1120mL,
答:反应生成气体的体积(标准状况)为1120mL;
(3)根据质量守恒定律,钠离子的物质的量为n(Na+)=2n(Na2CO3)=0.05mol×2=0.1mol,
假设反应前后溶液体积不变,所得溶液中的Na+的物质的量浓度为:c(Na+)=$\frac{0.1mol}{0.1L+0.1L}$=0.5mol/L,
答:所得溶液中Na+的物质的量浓度为0.5mol/L;
(4)c(浓)•V(浓)=c(稀)•V(稀)可知,1L×0.5mol/L=0.1mol/L×V(稀),则V(稀)=5L;
答:所得溶液的体积是5L.
点评 本题考查了碳酸钠与盐酸的反应及简单的化学计算,题目难度中等,注意熟练掌握常见元素化合物的性质及反应方程式,试题有利于培养学生灵活应用所学知识解决实际问题的能力.

 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡油分解);试管②放在冷水中;试管③中加入溴的四氯化碳溶液. ;
; .
. ,该反应的反应类型为加成反应.
,该反应的反应类型为加成反应.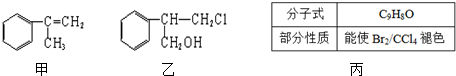

 +HCl$\stackrel{一定条件}{→}$
+HCl$\stackrel{一定条件}{→}$ (不需注明反应条件).
(不需注明反应条件).
 .
. 、
、 、
、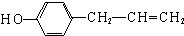 .
.

