题目内容
13.下列各组物质能相互反应且属于复分解反应的是( )| A. | 镁与稀硫酸 | B. | 氧化钙与水 | ||
| C. | 氢氧化钠溶液与硝酸钾溶液 | D. | 氢氧化钙与硫酸 |
分析 A.Mg与稀硫酸反应生成硫酸镁和氢气;
B.CaO与水反应生成氢氧化钙;
C.NaOH和硝酸钾不反应;
D.氢氧化钙与硫酸反应生成硫酸钙和水.
解答 解:A.Mg与稀硫酸反应生成硫酸镁和氢气,为置换反应,故A不选;
B.CaO与水反应生成氢氧化钙,为化合反应,故B不选;
C.NaOH和硝酸钾不反应,不符合复分解反应的条件,故C不选;
D.氢氧化钙与硫酸反应生成硫酸钙和水,为复分解反应,故D选;
故选D.
点评 本题考查物质的性质及反应,为高频考点,把握物质的性质、发生的反应、反应分类为解答的关键,侧重分析与应用能力的考查,注意基本反应类型的判断,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
3.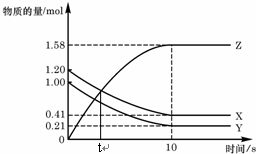 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
4.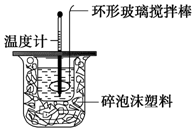 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1.则中和热△H=-53.5kJ•mol-1(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2S O4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
18.化学与生产、生活密切相关,下列说不正确的是( )
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 利用丁达尔效应鉴别 Fe(OH)3胶体和FeCl3溶液 |
5.下列现象与胶体的性质无关的是( )
| A. | 早晨的树林里会看到太阳透过树叶射出的美丽光束 | |
| B. | 浑浊的水可以用明矾净化 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 尿毒症患者做“血液透析” |
2.下列说法不正确的是( )
| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3-分别都不能大量共存(常温下) | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+; pH=2的溶液:NO3-、Fe2+、Na+、Al3+分别都可以大量共存(常温下) | |
| C. | 已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的KSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | |
| D. | 表示H2燃烧热的化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1);△H=-285.8kJ/mol |
20.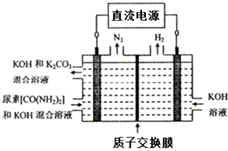 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
2NH3(g)+C02(g)$\stackrel{一定条件}{?}$C0(NH2)2 (g)+H20(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
①70min 时,平均反应速率(CO2 )=5.7×10-4mol/(L•min)mol/(L min).
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大 (填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④如图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].2NH3(g)+C02(g)$\stackrel{一定条件}{?}$C0(NH2)2 (g)+H20(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大 (填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④如图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.