题目内容
14.碳酸氢钠溶液与氯化钙溶液混合有白色沉淀产生,离子方程式:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O.分析 碳酸氢根离子能够电离出氢离子和碳酸根离子,碳酸根离子与钙离子生成碳酸钙沉淀,氢离子与碳酸氢根离子结合生成二氧化碳和水,据此书写离子方程式.
解答 解:碳酸氢钠溶液与氯化钙溶液混合有白色沉淀产生,该沉淀只能为CaCO3,反应的离子方程式为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,
故答案为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O.
点评 本题考查离子方程式的书写,题目难度不大,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
10.W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,X原子的电子层数比Y、Z少一层,下列说法正确的是( )
| A. | 原子半径的大小顺序为:Z>Y>X>W | |
| B. | 元素的非金属性:X>Y | |
| C. | 若X的单质为常见的非金属导体,则含Y的离子在水溶液中呈酸性 | |
| D. | 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者 |
11.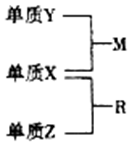 X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂.下列说法不正确的是( )
X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂.下列说法不正确的是( )
 X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂.下列说法不正确的是( )
X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂.下列说法不正确的是( )| A. | X元素位于周期表中的第16列 | |
| B. | X的氢化物沸点一定高于Y的氢化物的沸点 | |
| C. | X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制 | |
| D. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 |
19.下列是必修2中出现的典型有机物,有关性质描述正确的是( )
①CH4
②CH2=CH2
③
④CH3CH2OH
⑤CH3COOH
⑥CH3COOCH2CH3.
①CH4
②CH2=CH2
③

④CH3CH2OH
⑤CH3COOH
⑥CH3COOCH2CH3.
| A. | ②④均能发生加成反应 | B. | ①⑥均能发生取代反应 | ||
| C. | ②③均能使酸性KMnO4溶液褪色 | D. | ④⑤均能与NaOH溶液发生反应 |
3.有四种短周期的主族元素R,E,X,Y,其在周期表中的位置如图所示R,X,Y的原子序数之和为37,下列有关说法正确的是( )
| R | |||
| E | X | Y |
| A. | X的氢化物稳定性比R的氢化物稳定 | |
| B. | E和Y组成的化合物溶于水能促进水的电离 | |
| C. | 0.1mol/L的Y的最高价氧化物对应水化物的pH=1 | |
| D. | E与足量一水合氨反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2 |
 ,反应类型取代反应.
,反应类型取代反应.
 .
.