题目内容
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2.
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
⑤晶体的熔点:SiO2>NaCl>CCl4>SO2.
| A、②④⑤ | B、①②④ |
| C、③⑤ | D、全部正确 |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较,晶体熔沸点的比较
专题:元素周期律与元素周期表专题
分析:①元素的非金属越强,对应的氢化物越稳定;
②根据同周期元素从左到右原子半径逐渐减小,从上到下原子半径逐渐增大判断;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④电解质越弱,对应的阴离子结合H+能力越强;
⑤一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高.
②根据同周期元素从左到右原子半径逐渐减小,从上到下原子半径逐渐增大判断;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④电解质越弱,对应的阴离子结合H+能力越强;
⑤一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高.
解答:
解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,故①错误;
②同周期元素从左到右原子半径逐渐减小,则Na>Mg,原子核外电子层数越少,半径越小,则F原子半径最小,故②正确;
③非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③错误;
④HCl、HCOOH、H2O电离常数逐渐减小,则电解质越弱,对应的阴离子结合H+能力越强,故④正确;
⑤一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高,则晶体的熔点体的熔点:SiO2>NaCl>CCl4>SO2,故⑤正确.
故选A.
②同周期元素从左到右原子半径逐渐减小,则Na>Mg,原子核外电子层数越少,半径越小,则F原子半径最小,故②正确;
③非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③错误;
④HCl、HCOOH、H2O电离常数逐渐减小,则电解质越弱,对应的阴离子结合H+能力越强,故④正确;
⑤一般来说晶体的熔点:原子晶体>离子晶体>分子晶体,结构相似的分子晶体,相对分子质量越大,熔点越高,则晶体的熔点体的熔点:SiO2>NaCl>CCl4>SO2,故⑤正确.
故选A.
点评:本题考查较为综合,涉及元素周期律、晶体的熔点以及酸性的比较,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律以及元素、单质、化合物的性质的联系,难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
下列叙述中错误的是( )
| A、原子半径:Cl>S>O |
| B、还原性:Na>Mg>Al |
| C、稳定性:HF>HCl>HBr |
| D、酸性:HClO4>H2SO4>H3PO4 |
当光束通过下列分散系时,不能产生丁达尔效应的是( )
| A、雾 |
| B、Fe(OH)3胶体 |
| C、盐酸 |
| D、稀豆浆 |
下列各组中两个变化所发生的反应,属于同一类型的是( )
①由苯制环己烷;由乙烯制溴乙烷
②乙烯使溴水褪色;乙炔使酸性高锰酸钾水溶液褪色
③由乙烯制聚乙烯;由1-丁醇制1-丁烯
④由苯制硝基苯;甲烷与氯气反应.
①由苯制环己烷;由乙烯制溴乙烷
②乙烯使溴水褪色;乙炔使酸性高锰酸钾水溶液褪色
③由乙烯制聚乙烯;由1-丁醇制1-丁烯
④由苯制硝基苯;甲烷与氯气反应.
| A、只有②③ | B、只有③④ |
| C、只有①③ | D、只有①④ |
下列说法是否正确?( )
①将 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2
②乙酰水扬酸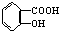 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备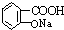
③从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
④实验时手指不小心沾上苯酚,立即用70°以上的热水清洗.
①将
 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②乙酰水扬酸
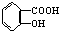 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备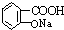
③从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
④实验时手指不小心沾上苯酚,立即用70°以上的热水清洗.
| A、都不正确 | B、只有①③正确 |
| C、只有②④正确 | D、都正确 |
反应:2A(g)+B(g)═3C(g)+4D(g),在不同条件下,同一时间内用不同物质表示其反应速率,如下:则此反应在不同条件下进行最快的是( )
| A、v(A)=0.5mol/(L?s) |
| B、v(B)=0.3 mol/(L?s) |
| C、v(C)=0.8 mol/(L?s) |
| D、v(D)=1 mol/(L?s) |
某碳酸二元酯的分子式为C7H14O3,其结构为R1OCOOR2(R1、R2为烃基)若不考虑立体异构,该碳酸二元酯的结构共有( )
| A、10种 | B、15种 |
| C、18种 | D、24种 |
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构如图所示,下列有关该化合物的说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构如图所示,下列有关该化合物的说法不正确的是( )| A、分子式为C14H20O |
| B、该化合物可发生聚合反应 |
| C、1mol该化合物完全燃烧消耗17.5mol O2 |
| D、1mol该化合物能与2 mol Br2发生加成反应 |