题目内容
短周期主族元素A、B、C、D原子序数依次递增,A、B、D三种元素既不同周期也不同主族,且三元素原子的最外层电子数之和为13,B与C同周期,C的最外层电子数比B的最外层电子数多1.下列有关说法正确的是( )
| A、元素D的单质只能做氧化剂 |
| B、元素B和D可以形成化学式为BD3的共价化合物 |
| C、A、B两种元素形成的化合物的空间构型一定是三角锥形 |
| D、元素A、C不可能形成结构式为A-C-C-A的化合物 |
考点:原子结构与元素的性质
专题:
分析:短周期主族元素A、B、C、D原子序数依次递增,A、B、D三种元素既不同周期也不同主族,则A为H元素,B处于第二周期、D处于第三周期,且三元素原子的最外层电子数之和为13,故B、D三元素原子最外层电子数为13-1=12,B与C同周期,C的最外层电子数比B的最外层电子数多1,则B的最外层电子数只能为5,D的最外层电子数为7,故B为N元素,D为Cl元素,C为O元素,据此解答.
解答:
解:短周期主族元素A、B、C、D原子序数依次递增,A、B、D三种元素既不同周期也不同主族,则A为H元素,B处于第二周期、D处于第三周期,且三元素原子的最外层电子数之和为13,故B、D三元素原子最外层电子数为13-1=12,B与C同周期,C的最外层电子数比B的最外层电子数多1,则B的最外层电子数只能为5,D的最外层电子数为7,故B为N元素,D为Cl元素,C为O元素,
A.氯气在某些反应中可以做还原剂,故A错误;
B.NCl3是共价化合物,故B错误;
C.N、H两种元素形成的化合物不只氨气一种,还有其他物质,不一定是三角锥形,过C错误;
D.H、O元素可以形成H2O2,其结构式为H-O-O-H,故D正确,
故选D.
A.氯气在某些反应中可以做还原剂,故A错误;
B.NCl3是共价化合物,故B错误;
C.N、H两种元素形成的化合物不只氨气一种,还有其他物质,不一定是三角锥形,过C错误;
D.H、O元素可以形成H2O2,其结构式为H-O-O-H,故D正确,
故选D.
点评:本题考查结构性质位置关系综合应用,推断元素是解题关键,题目比较综合,需要学生熟练掌握基础知识,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上利用N2和H2反应制取NH3,下列措施不能加快该反应的反应速率的是( )
| A、升高温度 |
| B、增大压强 |
| C、将NH3及时分离 |
| D、使用催化剂 |
下列关于常见有机物的说法中正确的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原理相同 |
| B、甲烷与氯气在光照条件下反应可以制取较纯净的一氯甲烷 |
| C、乙烯和乙烷可用酸性高锰酸钾溶液来鉴别 |
| D、苯分子中含有碳碳双键,所以苯可以和H2发生加成 |
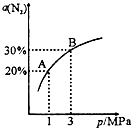 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α%)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α%)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A、将1.0mol氮气和3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B、平衡状态由A变到B时,平衡常数K(A)<K(B) |
| C、上述反应在达到平衡后,增大压强,H2的转化率提高 |
| D、升高温度,平衡向逆反应方向移动 |
下列物质是强电解质是( )
| A、氧化铝 | B、晶体硅 |
| C、盐酸 | D、氨水 |
已知热化学方程式:2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ/mol.则对于热化学方程式:2H2O(l)=2H2(g)+O2(g)△H2=b,下列说法正确的是( )
| A、热化学方程式中化学计量数表示分子个数 |
| B、该反应的△H2=+483.6 kJ/mol |
| C、△H2<△H1 |
| D、△H2>△H1 |
