题目内容
25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为( )
| A、1010:1 |
| B、5×109:1 |
| C、108:1 |
| D、1:1 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:根据H2O=H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,根据溶液的PH为11,求出水电离出的c(H+)利用水的离子积常数求出氢氧化钠电离出的OH-离子浓度.
解答:
解:pH=11的NaOH溶液,水电离的c(H+)=10-11mol/L,根据水的离子积常数由NaOH电离产生的c(OH-)=
mol/L=10-3mol/L,而由水电离产生的c(OH-)=c(H+)=10-11mol/L,所以由氢氧化钠电离出的OH-离子浓度与水电离出的OH-离子浓度之比:10-3mol/L:10-11mol/L=108,
故选:C.
| 1×10-14 |
| 10-11 |
故选:C.
点评:本题考查PH的简单计算,题目难度不大,注意碱水的电离平衡移动的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述不正确的是( )
| A、石油的裂化和裂解可以得到烯烃 |
| B、石油的催化重整是获得芳香烃的主要途径 |
| C、石油分馏出的各馏分均是纯净物 |
| D、煤干馏产生的煤焦油经分馏可得到芳香烃 |
下列醇类物质中,不能被氧化成醛的是( )
| A、CH3-CH2-CH2-OH |
| B、CH3-CH2-OH |
C、 |
D、 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Na+、H+、Cl-、CO32- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、Ca2+、Cl-、NO3- |
| D、K+、H+、SO42-、OH- |
在11Na、12Mg、13Al、14Si、15P、16S、17Cl、18Ar八种元素中,能用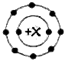 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )
 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )| A、1种 | B、2种 | C、3种 | D、4种 |
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)△H<0 的化学反应下列叙述不正确的是( )
A、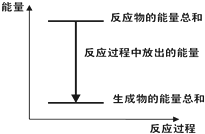 反应过程中能量关系可用如图表示 |
| B、△H的值与反应方程式的计量系数有关 |
| C、若将该反应设计成原电池锌为负极 |
| D、若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L |
C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及化合物的说法中不正确的是( )
| A、三种元素的单质都存在同素异形体 |
| B、二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应 |
| C、最低价的气态氢化物都具有较强的还原性,能与O2发生反应 |
| D、含氧酸的钠盐水溶液有呈碱性的,有呈中性、也有酸性的 |
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)△H>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)△H>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )| A、恒温恒容条件下将A、B的浓度增加一倍 |
| B、恒温条件下加压(缩小容器体积) |
| C、使用合适的催化剂 |
| D、升高温度 |