题目内容
金属晶体、离子晶体、分子晶体和原子晶体的根本区别是( )
| A、基本构成微粒和微粒间的作用力不同 |
| B、外部形状不同 |
| C、金属晶体和原子晶体属于单质,分子晶体和离子晶体属于化合物 |
| D、基本构成微粒做周期性重复排列所遵循的规律不同 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:晶体划分的标准是微观粒子的种类及粒子间的相互作用,据此分析.
解答:
解:晶体划分的标准是微观粒子的种类及粒子间的相互作用,如由离子构成且粒子之间是离子键的属离子晶体,由分子通过分子间作用力构成的物质为分子晶体,由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体,金属阳离子和自由电子通过金属键结合形成金属晶体.
故选:A.
故选:A.
点评:本题考查了晶体的分类依据,题目难度不大,明确晶体划分的标准是微观粒子的种类及粒子间的相互作用即可解答.

练习册系列答案
相关题目
要将桌上燃着的酒精扑灭,宜采取的措施是( )
| A、用水泼灭 |
| B、投入冰块冷却降温 |
| C、用扇子扇灭 |
| D、用湿抹布或沙子盖灭 |
下列叙述错误的是( )
(1)所有的碱性氧化物都是金属氧化物
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物.
(1)所有的碱性氧化物都是金属氧化物
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物.
| A、全部 |
| B、(1)(2)(3)(4) |
| C、(1)(2)(3)(5) |
| D、(2)(3)(4)(5) |
某温度下,N2O4(g)?2NO2(g);△H>0.在密闭容器中达到平衡,下列说法不正确的是( )
| A、加压时(减小体积),将使正、逆反应速率增大,平衡向逆反应方向移动 |
| B、保持体积不变,加入少许NO2,将使正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C、保持体积不变,加入少许N2O4,再达到平衡时,颜色变深 |
| D、保持体积不变,升高温度,再达平衡时颜色变深 |
4一甲基一2一乙基一1一戊烯经催化加氢后所得产物的名称为( )
| A、4一甲基一2一乙基戊烷 |
| B、2,5一二甲基戊烷 |
| C、2一乙基一4一甲基戊烷 |
| D、2,4一二甲基己烷 |
下列说法中不正确的是( )
| A、可燃物遇到氧气不一定燃烧 |
| B、缓慢氧化不一定能引起自燃 |
| C、自燃不一定由缓慢氧化引起 |
| D、剧烈燃烧不一定引起爆炸 |
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2L NO与11.2L O2混合后气体分子数为0.75NA |
| C、106g Na2CO3固体中的阴离子数为NA |
| D、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
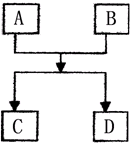 已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.
已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.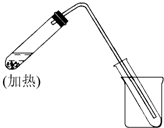 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题: