题目内容
1. 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.(1)氧化-还原法消除氮氧化物的转化如下:NO$→_{反应Ⅰ}^{O_{3}}$NO2$→_{反应Ⅱ}^{CO(NH_{2})_{2}}$N2
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2L O2(标准状况)时,转移电子的物质的量是1mol.
②反应Ⅱ中,当n(NO2):n[CO(NH2)2]=3:2时,反应的化学方程式是6NO2+4CO(NH2)2=7N2+8H2O+4CO2.
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1,已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,写出NO和O2反应生成NO2的热化学方程式:2NO(g)+O2(g)=2NO2(g),△H=-113.0 kJ•mol-1.
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.该反应的化学平衡常数表达式K=c2(NH3)•c(CO2).关于该反应的下列说法正确的是a(填序号).
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
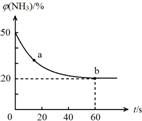
②密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO (NH2)2 (s)+H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示.则a点的正反应速率v(正)(CO2)>b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
分析 (1)①根据化合价的变化来确定电子转移数目;
②反应方程式中,化学计量数之比等于物质的量之比;
(2)①NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,
根据盖斯定律由②-①×2进行计算,书写热化学方程式;
(3)①化学平衡常数=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$,固态和纯液体不列入;a、该反应中只有生成物是气体,生成的氨气和二氧化碳质量和物质的量比值不变;
b、化学平衡常数只受温度影响;
c、降温平衡向逆向移动;
②图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率.
解答 解:(1)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5molO2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的化学计量数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:①NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,
由②-①×2得:2NO(g)+O2(g)=2NO2(g),△H=-196.6kJ•mol-1-2×(-41.8kJ•mol-1)=-113.0 kJ•mol-1,
故答案为:2NO(g)+O2(g)=2NO2(g),△H=-113.0 kJ•mol-1;
(3)①尿素和水不是气体,不列入,其化学平衡常数=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$=c2(NH3)•c(CO2),
a、混合气体的平均相对分子质量=$\frac{混合气体的质量总和}{混合气体的物质的量总和}$,该反应中只有生成物是气体,生成的氨气和二氧化碳质量和物质的量比值不变,故a正确;
b、化学平衡常数只受温度影响,温度不变其不变,故b错误;
c、该反应是吸热反应,降温平衡逆向移动,反应物转化率降低,故c错误;
故答案为:c2(NH3)•c(CO2);a;
②氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:>;75%.
点评 本题考查的知识点较多,综合性较强,涉及氧化还原反应、盖斯定律的应用以及化学平衡的有关计算知识,难度较大.侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键.

| A. | Na+、Mg2+、Al3+、Cl- | B. | Na+、AlO2-、Cl-、OH- | ||
| C. | Na+、Mg2+、Al2O-、Cl- | D. | Na+、Al3+、Al2O-、Cl- |
| A. | 1:3 | B. | 3:2 | C. | 1:4 | D. | 2:7 |
 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A. | 还原性:HSO${\;}_{3}^{-}$>I-,氧化性:IO${\;}_{3}^{-}$>I2>SO${\;}_{4}^{2-}$ | |
| B. | a点处的氧化产物是SO${\;}_{4}^{2-}$,还原产物是I- | |
| C. | 当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol | |
| D. | 若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO${\;}_{3}^{-}$+5HSO${\;}_{3}^{-}$═I2+5SO${\;}_{4}^{2-}$+3H++H2O |
| A. | 月球上的H2O分子中只含有非极性共价键 | |
| B. | H2O在化学反应中既可作氧化剂又可作还原剂 | |
| C. | 氢的三种同位素H、D、T与16O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
