题目内容
在温度、容积相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
(已知N2(g)+3H2 (g)?2NH3(g)△H=-92.4kJ?mol-1)
下列说法不正确的是( )
(已知N2(g)+3H2 (g)?2NH3(g)△H=-92.4kJ?mol-1)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3 的浓度(mol?L-1 ) | c1 | c2 | c3 |
| 反应的能量变化 | 放出 akJ | 吸收 bkJ | 吸收 ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A、2p2>p3 |
| B、a+b=92.4 |
| C、2c1>c3 |
| D、α1+α2=1 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入1molN2、3molH2,丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动.
甲容器反应物投入1molN2、3molH2,丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动.
解答:
解:甲投入1molN2、3molH2,乙容器投入量2molNH3,恒温恒容条件下,甲容器与乙容器是等效平衡,各组分的物质的量、含量、转化率等完全相等;
而甲容器投入1molN2、3molH2,丙容器加入4molNH3,采用极限转化法丙相当于加入2molN2、6molH2,丙中加入量是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器为等效平衡,所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以丙中氮气、氢气转化率大于甲和乙的,
A、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故A正确;
B、甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B正确;
C、丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,若平衡不移动,c3=2c1;丙相当于增大压强,平衡向着正向移动,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c1,故C错误;
D、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减小,所以转化率α1+α3<1,甲容器和乙容器是达到等效平衡状态,甲正向进行,乙逆向进行,则α1+α2=1故D正确;
故选C.
而甲容器投入1molN2、3molH2,丙容器加入4molNH3,采用极限转化法丙相当于加入2molN2、6molH2,丙中加入量是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器为等效平衡,所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以丙中氮气、氢气转化率大于甲和乙的,
A、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故A正确;
B、甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B正确;
C、丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,若平衡不移动,c3=2c1;丙相当于增大压强,平衡向着正向移动,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c1,故C错误;
D、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减小,所以转化率α1+α3<1,甲容器和乙容器是达到等效平衡状态,甲正向进行,乙逆向进行,则α1+α2=1故D正确;
故选C.
点评:本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,题目难度较大,关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列化学式的物质中只含有共价键是( )
| A、NaOH |
| B、Al2O3 |
| C、HCl |
| D、Ne |
PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)?PCl5(g).有关数据如下:
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10min内,v(Cl2)=0.04mol/(L?min) |
| B、当反应达到平衡时,容器中Cl2为1.2mol |
| C、升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)=0.2mol/L |
在某温度下,反应S2Cl2(l)+Cl2(g)?2SCl2(l);△H=-5016kJ/mol,在密闭容器中达到平衡,下列说法错误的是( )
橙黄色 鲜红色.
橙黄色 鲜红色.
| A、温度不变,增大容器的体积,液体的颜色变浅 |
| B、温度不变,减少容器的体积,S2Cl2的转化率降低 |
| C、压强不变,升高温度,液体的颜色变浅 |
| D、体积不变,降低温度,氯气的转化率升高 |
下列叙述正确的是( )
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、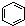 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、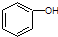 和 和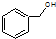 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.已知H-H键键能为436kJ?mol-1,N-H键键能为391kJ?mol-1,根据热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1.则N≡N键的键能( 单位:kJ?mol-1 )是( )
| A、431 | B、649 |
| C、896 | D、945.6 |
下列选项正确的是( )
 制取氧气 |  制取Fe(OH)2 |  用盐酸滴定NaOH溶液 |  制备乙酸乙酯 |
| A | B | C | D |
| A、A | B、B | C、C | D、D |