题目内容
14.将铁片放入下列溶液中,溶液质量增加,但没有气体放出的是( )| A. | AlCl3溶液 | B. | FeCl3溶液 | C. | CuSO4溶液 | D. | 稀盐酸 |
分析 铁和溶液中的溶质反应,导致铁片溶解,溶液质量增加且没有气体生成,说明铁和溶液反应时不是和酸反应,且不能置换出比铁的摩尔质量大的金属单质,据此解答.
解答 解:A.铝性质强于铁,铁与氯化铝不反应,溶液质量不变化,故A不选;
B.铁与氯化铁反应生成氯化亚铁,铁溶解,溶液质量增加,没有气体放出,故B选;
C.铁与硫酸铜反应生成铜和硫酸亚铁溶液,溶液质量减小,C不选;
D.铁与盐酸反应生成氢气,故D不选;
故选:B.
点评 本题考查铁的化学性质,注意探究与铁反应后溶液质量增减的问题,根据与铁反应前后溶质的相对分子质量的大小来确定溶液质量的增减即可,难度不大.

练习册系列答案
相关题目
4.铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(2)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2,若有1,.5mol Fe3O4参加反应,转移电子的物质的量是12mol.
(3)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(2)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2,若有1,.5mol Fe3O4参加反应,转移电子的物质的量是12mol.
(3)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是B(填字母).
| 陈述Ⅰ | 陈述Ⅱ | 判断 | |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁表面形成致密氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对,有 |
5.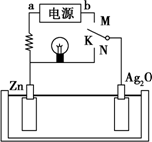 如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
 如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )
如图是某二次电池充、放电时的工作示意图,已知放电时电池反应为Zn+Ag2O+H2O═2Ag+Zn(OH)2.下列有关说法正确的是( )| A. | 放电时的负极反应和充电时的阴极反应属于可逆反应 | |
| B. | 在电池放电过程中溶液的pH增大 | |
| C. | K与N相接时,能量由化学能转化为电能,溶液中的OH-向正极区移动 | |
| D. | K与M连接时,所用电源的a极为负极,阳极附近溶液的pH逐渐增大 |
2.下列离子方程式正确的是( )
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | Fe3O4与HCl:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | Fe2O3与Hl:Fe2O3+6H+═2Fe3++3H2O |
9.11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是( )
| A. | 6:11 | B. | 5:6 | C. | 11:6 | D. | 6:5 |
19.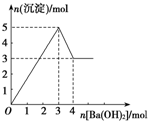 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO4 | B. | KAl(SO4)2 | C. | Al2(SO4)3 | D. | Na AlO2 |
6.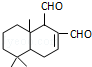 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )
 某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团种类减少,则该试剂是( )| A. | Br2的CCl4溶液 | B. | HBr | C. | Ag(NH3)2OH溶液 | D. | H2 |
 如图甲、乙是电化学实验装置.请回答下列问题:
如图甲、乙是电化学实验装置.请回答下列问题: