题目内容
16.实验室用KClO3分解(MnO2做催化剂)制取氧气,实验后回收剩余固体中的MnO2,正确的操作步骤是( )| A. | 溶解、过滤、蒸发 | B. | 溶解、过滤、洗涤、干燥 | ||
| C. | 溶解、过滤、结晶 | D. | 溶解、结晶、干燥 |
分析 剩余物质中有KCl(或含KClO3)和MnO2,要想回收MnO2,应利用KCl(或含KClO3)溶于水,但MnO2不溶于水,以此来解答.
解答 解:实验室加热氯酸钾与MnO2的混合物制氧气,发生2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,剩余物质中有KCl(或含KClO3)和MnO2,要想回收MnO2,要利用KCl(或含KClO3)溶于水,但MnO2不溶于水,应先将混合物溶解,然后过滤得MnO2固体,然后将MnO2固体洗涤并干燥即可,
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
6.用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻棒外,还需要的玻璃仪器有1000mL容量瓶
(2)滴定:①盛装0.1000mol/L的盐酸标准液应该使用酸式滴定管.
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化.
(3)有关数据记录如下:
计算纯度:烧碱样品的纯度是80.4%; (取两次实验所耗盐酸的平均值进行计算)
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,会使测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果偏高.
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻棒外,还需要的玻璃仪器有1000mL容量瓶
(2)滴定:①盛装0.1000mol/L的盐酸标准液应该使用酸式滴定管.
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化.
(3)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,会使测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果偏高.
7.化学已渗透到人类生活的各个方面,下列说法的错误是( )
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |
11.碘是人体必需的微量元素之一.在市场中购买的加碘盐加入的是( )
| A. | I2 | B. | NaIO | C. | KI | D. | KIO3 |
1.下列说法中不正确的是( )
| A. | SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 硅胶可做袋装食品的干燥剂 | |
| D. | 晶体硅可用于制作半导体材料与其熔点高硬度大无关 |
8.(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈灰黑色,实验E中的金属呈紫红色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(2)在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
①压强从200kPa增加到500kPa时,平衡不移动(填“正向”“逆向”或“不”),理由是浓度增大的倍数和压强增大的倍数相同.
②压强从500kPa增加到1 000kPa时,平衡正向转移(填“正向”“逆向”或“不”),其原因可能是加压至1000kPa时,C物质变成了非气态物质.
5.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1L 0.1mol•L-1的纯碱溶液中含有0.1NA个Na+ | |
| B. | 常温常压下,23g NO2中含有NA个氧原子 | |
| C. | 常温常压下,22.4L CCl4含有个NACCl4分子 | |
| D. | 1molFe与足量的盐酸反应,转移3NA个电子 |
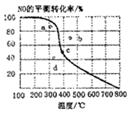 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )