题目内容
下列物质既不是电解质,又不是非电解质的是( )
| A、食盐水 |
| B、H2O |
| C、NaHSO4 |
| D、Ca(OH)2 |
考点:电解质与非电解质
专题:电离平衡与溶液的pH专题
分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,单质、混合物既不是电解质也不是非电解质.
解答:
解:A、食盐水是混合物既不是电解质也不是非电解质,故A正确;
B、水能电离出少量自由移动的阴阳离子,是电解质,故B错误;
C、NaHSO4在水溶液里能电离出自由移动的阴阳离子,是电解质,故C错误;
D、Ca(OH)2能电离出自由移动的阴阳离子,是电解质,故D错误;
故选A.
B、水能电离出少量自由移动的阴阳离子,是电解质,故B错误;
C、NaHSO4在水溶液里能电离出自由移动的阴阳离子,是电解质,故C错误;
D、Ca(OH)2能电离出自由移动的阴阳离子,是电解质,故D错误;
故选A.
点评:本题考查电解质、非电解质的概念,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
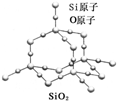

| A、晶体中Si、O原子个数比为1:2 |
| B、晶体中Si、O原子最外层都满足8电子结构 |
| C、晶体中一个硅原子含有Si-O键数目为4 |
| D、晶体中最小环上的原子数为6 |
铝能用于冶炼难熔的金属,这是因为铝具有( )
| A、两性 |
| B、优良的导电性 |
| C、低的熔点 |
| D、还原性,且在冶炼反应中放出大量热 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2,有关该电池的说法正确的是( )
| 放电 |
| 充电 |
| A、充电过程中镉元素被氧化 |
| B、充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
| C、放电时负极附近溶液的碱性不变 |
| D、放电时电解质溶液中的OH-向正极移动 |
关于如图所示装置的叙述,正确的是( )
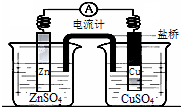

| A、铜是阳极,铜片上有气泡产生 |
| B、盐桥中的阳离子会移向CuSO4溶液 |
| C、正极附近的SO42-离子浓度逐渐增大 |
| D、锌离子在锌片表面被还原 |
1.00L 1.00mol?L-1 NaOH溶液与足量的稀盐酸反应,放出 57.4kJ的热量.表示该反应的中和热的热化学方程式正确的是( )
| A、NaOH+HCl═NaCl+H2O△H=+57.4kJ?mol-1 |
| B、NaOH+HCl═NaCl+H2O△H=-57.4 kJ?mol-1 |
| C、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ?mol-1 |
| D、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ?mol-1 |
氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 |
| B、该反应利用了Cl2的强氧化性 |
| C、NH3发生还原反应 |
| D、生成1 mol N2有6 mol电子转移 |
下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是( )
| A、K+、MnO4-、Cl-、SO42- |
| B、Na+、CO32-、Cl-、SO42- |
| C、NO3-、Na+、HCO3-、Ba2+ |
| D、Na+、NO3-、NH4+、SO42- |
下列物质中,不含有硅酸盐的是( )
| A、水玻璃 | B、硅芯片 |
| C、陶瓷 | D、普通水泥 |