题目内容
13.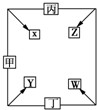 甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:
甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,其转化关系如图所示.又如:①甲、乙、丙均为前三周期元素的单质,常温下均为气态;丁是日常生活中一种常见的金属.
②常温下X是无色液体,Y是黑色固体.
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色.
(1)丁在甲和X同时存在的条件下,可发生电化腐蚀,写出正极上的电极反应式:O2+2H2O+4e-═4OH-.
(2)将少量W的饱和溶液滴入热的X中,反应的化学方程式是FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
(3)若Z、W两溶液的pH均等于5,则两溶液中由水电离出的H+的物质的量浓度之比为1:104.
(4)已知5.6L(标准状况)气体丙在甲中完全燃烧放出热量为71.45KJ,则能正确表示丙燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ•mol-1.
分析 根据甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,甲、乙、丙均为前三周期元素的单质,常温下均为气态,甲和丙反应产生X,X是无色液体,因此X是水,是氢气和氧气反应产生的水;丁是日常生活中的一种常见金属常温下,丁和甲反应产生Y,Y是黑色固体,因此是铁和氧气反应产生四氧化三铁,则Y是四氧化三铁;由此可知甲是氧气,丙是氢气,丁是铁;丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色,可知乙是氯气,则Z为氯化氢,W为氯化铁,据此分析完成相关的问题.
解答 解:根据甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,甲、乙、丙均为前三周期元素的单质,常温下均为气态,甲和丙反应产生X,X是无色液体,因此X是水,是氢气和氧气反应产生的水;丁是日常生活中的一种常见金属常温下,丁和甲反应产生Y,Y是黑色固体,因此是铁和氧气反应产生四氧化三铁,则Y是四氧化三铁;由此可知甲是氧气,丙是氢气,丁是铁;丙在乙中燃烧发出苍白色的火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色,可知乙是氯气,则Z为氯化氢,W为氯化铁,带入验证符合转化关系,
(1)铁在氧气和水同时存在的条件下,可发生吸氧腐蚀,其正极上氧气得电子生成氢氧根离子,反应的电极反应式为O2+2H2O+4e-═4OH-,
故答案为:O2+2H2O+4e-═4OH-;
(2)将少量氯化铁的饱和溶液滴入热的水中,铁离子水解生成氢氧化铁胶体,反应的化学方程式是 FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH) 3(胶体)+3HCl,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH) 3(胶体)+3HCl;
(3)若盐酸和氯化铁两溶液的pH均等于5,在盐酸溶液中水电离出的H+的物质的量浓度为10-9mol/L,氯化铁溶液中水电离出的H+的物质的量浓度为10-5mol/L,则两溶液中由水电离出的H+的物质的量浓度之比为10-9:10-5=1:104,
故答案为:1:104;
(4)已知5.6L(标准状况)即0.25mol氢气在氧气中完全燃烧放出热量为71.45KJ,则1mol氢气燃烧放出的热量为285.8 kJ,所以氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8 kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8 kJ•mol-1.
点评 此题为框图型物质推断题,完成此题,关键是根据题干提供的信息,直接得出有关物质的化学式,然后顺推或逆推或由两边向中间推,得出其他物质的化学式.注意把握氯气与水的反应及氯水具有酸性和漂白性为解答的关键,HClO的漂白性为解答的易错点.

| A. | a-b=m-n | B. | b-d=m-n | C. | c-n=18 | D. | a-m=16 |
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s能级原子轨道呈球形,处于该轨道上的电子只能在球壳内运动 | |
| C. | p能级原子轨道呈哑铃状,随着能层的增加,p能级原子轨道也在增多 | |
| D. | p能级原子轨道与s能级原子轨道的平均半径都随能层序数的增大而增大 |
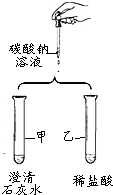 如图是某小组验证碳酸钠性质的实验方案.
如图是某小组验证碳酸钠性质的实验方案.(1)甲试管中反应的化学方程式为Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;
(2)乙试管中的现象是大量气泡.
实验后他们将废液倒入废液缸,小欣发现废液澄清.
【提出问题】废液中的溶质含有哪些成分?
【查阅资料】①CaCl2溶液呈中性
②CaCl2+Na2CO3═2NaCl+CaCO3↓
【提出猜想】可能是Ⅰ.CaCl2、NaClⅡ.CaCl2、NaCl HCl
【设计实验】验证你的猜想
| 实验步骤 | 实验现象 | 结论 |
| 取少量的废液于试管中,滴加2~3滴石蕊试液,振荡. | 无现象 | 废液的pH=7; 猜想Ⅰ成立. |
| A. | 无色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Fe2+、Na+、Cl-、NO3- | |
| C. | Na2CO3溶液:K+、NO3-、Cl-、Al3+ | |
| D. | $\frac{{K}_{W}}{c(H)}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
| 选项 | 操作和现象 | 结论 |
| A | 向溶液中加入KSCN溶液无明显现象,再加入新制氯水,溶液呈血红色 | 证明原溶液中含有Fe2+ |
| B | 加入AgNO3溶液后生成白色沉淀,加稀盐酸沉淀不溶解 | 可确定有Cl-存在 |
| C | 将某种气体通入酸性KMnO4溶液.溶液褪色 | 说明该气体一定具有漂白性 |
| D | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解 | 证明该溶液中存在AlO2- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 酸性氧化物都可以与强碱溶液反应 | |
| B. | 与水反应生成酸的氧化物都是酸性氧化物 | |
| C. | 金属氧化物都是碱性氧化物或两性氧化物 | |
| D. | 不能与酸反应的氧化物一定能与碱反应 |
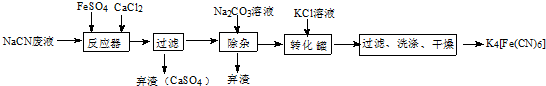
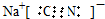 ;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
;实验室用NaCN固体配制NaCN溶液时,应先将其溶于NaOH溶液,再用蒸馏水稀释.
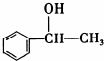 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.
 .
. .
. .
.