题目内容
13.将标况下的2.24LCO2通入150mL 1mol/LNaOH溶液中,下列说法正确的是( )| A. | c(Na+)等于c(CO32-)与c(HCO3-)之和 | B. | c(HCO3-) 等于c(CO32-) | ||
| C. | c(HCO3-) 略大于c(CO32-) | D. | c(HCO3-) 略小于c(CO32-) |
分析 n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生的反应为:2CO2+3OH-=CO32-+HCO3-+H2O,CO32-水解程度大于HCO3-,以此解答该题.
解答 解:n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,n(NaOH)=0.15L×1moL/L=0.15mol,二者发生的反应为:2CO2+3OH-=CO32-+HCO3-+H2O,由反应方程式可知,反应生成等物质的量的CO32-和HCO3-,由于CO32-水解程度大于HCO3-,则c(HCO3-) 略大于c(CO32-),故选C.
点评 本题考查混合物反应的计算和判断,可根据反应物的物质的量关系写出反应的化学方程式,注意把握盐的水解规律的应用,题目难度不大.

练习册系列答案
相关题目
3.下列说法不正确的是( )
| A. | 0.3mol/L的MgCl2溶液和0.2mol/L的AlCl3中Cl-的物质的量浓度不相同 | |
| B. | 氧化还原反应过程中一定存在电子的得失或共用电子对的偏移 | |
| C. | 无论什么状况下,质量一定的某种气体含有的分子数是一定的 | |
| D. | 相同状况下,气体的相对分子质量越大则气体密度越大 |
4.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)?2C(g)△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出关系图:
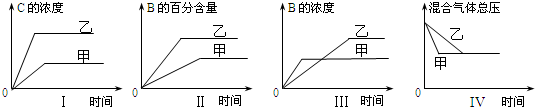
下列判断正确的是( )

下列判断正确的是( )
| A. | 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的是压强对反应的影响,且乙的压强较高 | |
| C. | 图Ⅲ研究的是温度对反应的影响,且甲的温度较高 | |
| D. | 图IV 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
1. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 从0s到10s,用Z表示的反应速率为0.16 mol/(L•s) | |
| B. | 从0s到10s,X的物质的量浓度减少了0.80 mol/L | |
| C. | 从0s到10 s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)=Z(g) |
8.已知:某温度下,H2(g)+I2(g)?2HI(g)的平衡常数为K1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数为K2,则K1、K2的关系为( )
| A. | K1=2K2 | B. | K1=K22 | C. | K1=K2 | D. | 不能确定 |
18.下列说法中正确的是( )
| A. | Na2O2,NaClO中含有化学键类型完全相同 | |
| B. | 只有活泼金属元素与活泼非金属元素之间才能形成离子键 | |
| C. | 等物质的量的CN-和N2含有的共用电子对数相等 | |
| D. | 氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
16.取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是( )
| A. | C2H2 C2H6 | B. | CH4 C3H8 | C. | C3H6 C3H8 | D. | C2H4 C4H8 |
17.下列食品添加剂与类别对应正确的一组是( )
| A. | 着色剂--苯甲酸钠 | B. | 调味剂--亚硝酸钠 | ||
| C. | 营养强化剂--粮食制品中加赖氨酸 | D. | 防腐剂--苋菜红 |