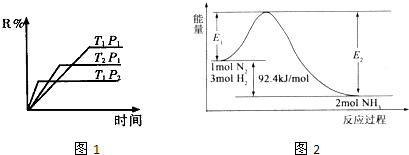
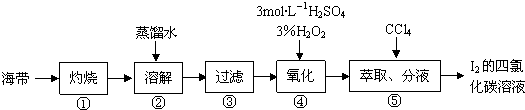
题目内容
取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体.实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色.请据以上实验事实分析:
(1)使湿润的红色石蕊试纸变蓝的气体是 ;
(2)写出NO3-发生反应的离子方程式,配平并填空.
Al+ NO3-+ + H2O→ AlO2-+
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的 (填离子符号)对实验结果有干扰.
(1)使湿润的红色石蕊试纸变蓝的气体是
(2)写出NO3-发生反应的离子方程式,配平并填空.
(3)为检验某含氮废水中是否含有NO3-,以废水水样2mL代替NaNO3溶液进行上述实验,现象相同,有同学认为无法据此得出“一定有NO3-”的结论,理由是废水中可能存在的
考点:含氮物质的综合应用
专题:氮族元素
分析:(1)氨气使湿润的红色石蕊试纸变蓝;
(2)依据元素化合价变化结合电子守恒配平书写离子方程式;
(3)铵根离子,亚硝酸根离子在碱溶液中被还原为氨气.
(2)依据元素化合价变化结合电子守恒配平书写离子方程式;
(3)铵根离子,亚硝酸根离子在碱溶液中被还原为氨气.
解答:
解:取2mL浓度为2×10-4mol/L的NaNO3溶液于试管,加入约4mL浓度为2mol/L的NaOH溶液,再加入适量铝粉,加热,用湿润的红色石蕊试纸检验产生的气体.实验中观察到试管中立即产生大量气泡,一段时间后试纸变蓝,铝粉溶解,溶液澄清不变色;
(1)使湿润的红色石蕊试纸变蓝的气体是NH3,故答案为:NH3;
(2)元素化合价变化结合电子守恒配平书写离子方程式;Al元素化合价0价变化为+3价,NO3-中 氮元素化合价+5价变化为-3价,电子守恒Al前系数为8,NO3-前系数为3,结合原子守恒和电荷守恒配平书写得到离子方程式为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3;
故答案为:8;3;5OH-;2;8;3NH3;
(3)废水中可能存在NH4+、NO2-,铵根离子,亚硝酸根离子在碱溶液中被还原为氨气,无法据此得出“一定有NO3-”的结论,故答案为:NH4+、NO2-.
(1)使湿润的红色石蕊试纸变蓝的气体是NH3,故答案为:NH3;
(2)元素化合价变化结合电子守恒配平书写离子方程式;Al元素化合价0价变化为+3价,NO3-中 氮元素化合价+5价变化为-3价,电子守恒Al前系数为8,NO3-前系数为3,结合原子守恒和电荷守恒配平书写得到离子方程式为:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3;
故答案为:8;3;5OH-;2;8;3NH3;
(3)废水中可能存在NH4+、NO2-,铵根离子,亚硝酸根离子在碱溶液中被还原为氨气,无法据此得出“一定有NO3-”的结论,故答案为:NH4+、NO2-.
点评:本题考查了物质性质分析判断,氧化还原反应电子守恒的理解应用,掌握题干信息和基础是关键,题目难度中等.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
下列有机反应属于同一反应类型的是( )
| A、乙烯使溴的四.氯化碳溶液褪色;苯使溴水褪色 |
| B、乙酸与氢氧化钠溶液反应;乙酸制乙酸乙酯 |
| C、乙醇使酸性高锰酸钾溶液褪色;葡萄糖与新制Cu(OH)2悬浊液共热得砖红色沉淀 |
| D、苯制溴苯;氯乙烯制塑料 |
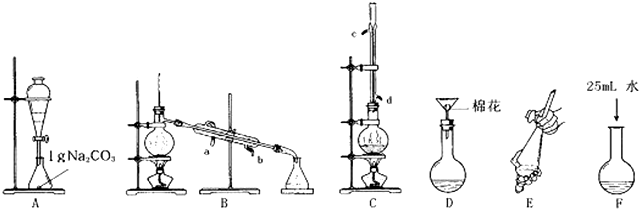
 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行试验测定中和热.下列说法正确的是( )
| A、烧杯间填满碎纸条的作用是固定小烧杯 |
| B、图中装置还需要增加一根玻璃棒进行搅拌 |
| C、量取NaOH溶液的体积时仰视进行操作,会使测出的中和热数值偏高 |
| D、若改用60 mL 0.55 mol/L盐酸与40 mL 0.50 mol/L的NaOH溶液进行反应,从理论上讲测出的中和热不变 |

 在沥青蒸气里含有多种稠环芳香烃,如图所示A、B、C …,
在沥青蒸气里含有多种稠环芳香烃,如图所示A、B、C …,