题目内容
3.乙酰水杨酸即阿斯匹林(aspirin)是一种解热止痛、治疗感冒药,实验室制取原理为:
实验方学科王法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g0.053mol),滴入3mL浓硫酸,在70℃反应一段时间后,按如下流程分离出乙酰水杨酸.

已知:①乙酰水杨酸学科王溶于热水,在冷水中微溶;熔点:136°C,沸点:321.4°C.
②乙酰水杨酸钡、水杨酸钡均可溶于水.
③乙酸酐遇水生成乙酸.
④乙酰水杨酸钠易溶于水,上述学科王粗产物中有少量难溶于水的聚合物.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠已反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中加入少量BaCl2溶液. (或取试管B中溶液做焰色反应实验). | 不产生白色沉淀(或焰色不呈黄色) | 产品中不含 Na2SO4 |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
分析 在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g 0.053mol),滴入5滴浓硫酸,在70℃反应一段时间,按流程分离出乙酰水杨酸,反应混合物加入冰水中稀释,乙酰水杨酸溶于热水,在冷水中微溶,防止乙酰水杨酸溶解过滤得到晶体加入饱和碳酸氢钠溶液到无气体生成,加入硫酸酸化冷却抽滤洗涤干燥得到较纯净的乙酰水杨酸;
(1)乙酰水杨酸溶于热水,在冷水中微溶,沿烧杯壁慢慢倒入冰水,并用玻璃棒不断搅拌;
(2)冰水中乙酰水杨酸为固体操作Ⅰ是过滤;
(3)粗产品加入饱和碳酸氢钠溶液反应生成二氧化碳;判断粗产物与饱和碳酸氢钠反应是否完全;
(4)验证硫酸根离子的存在或验证钠离子的存在证明是否含有硫酸钠;加入浓溴水或氯化铁溶液,利用酚羟基的性质检验是否含有水杨酸;
(5)在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、反应后理论上生成乙酰水杨酸0.045mol,实际生成3.2g,结合产率概念计算.
解答 解:(1)乙酰水杨酸溶于热水,在冷水中微溶,沿烧杯壁慢慢倒入冰水,并用玻璃棒不断搅拌进行稀释,操作步骤为:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中;
故答案为:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中;
(2)固液分离通常用过滤操作,冰水中乙酰水杨酸为固体操作Ⅰ是过滤,
故答案为:过滤;
(3)粗产品加入饱和碳酸氢钠溶液反应生成二氧化碳,判断粗产物与饱和碳酸氢钠反应是否完全可以依据是否有气泡生成判断,无汽泡证明反应完全;
故答案为:无气泡产生;
(4)产品中可能还含有少量水杨酸和Na2SO4,设计方案进行检验,实验证明不含杂质,验证硫酸根离子的存在或验证钠离子的存在证明是否含有硫酸钠,向试管B中加入少量BaCl2溶液(或取试管B中溶液做焰色反应实验);不产生白色沉淀(或焰色不呈黄色)证明无硫酸钠;加入浓溴水或氯化铁溶液,利用酚羟基的性质检验是否含有水杨酸,加入少量FeCl3溶液(或浓溴水),溶液不显紫色(或无白色沉淀出现)证明不含水杨酸;
故答案为:
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | |||
| ② | 向试管B中加入少量BaCl2溶液(或取试管B中溶液做焰色反应实验) | 不产生白色沉淀(或焰色不呈黄色) | |
| ③ | 加入少量FeCl3溶液(或浓溴水). | 溶液不显紫色(或无白色沉淀出现). |
故答案为:40%.
点评 本题考查了有机物制备方法和实验基本操作的分析应用,物质性质和 题干信息分析是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 一氯乙烷的结构式CH3Cl | |
| B. | 丁烷的结构简式CH3(CH2)2CH3 | |
| C. | 氯化氢分子的形成过程可用电子式表示为: | |
| D. | 四氯化碳的电子式 |
| A. | 乙烯和聚乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 等质量的乙烯与聚乙烯完全燃烧,产生的CO2质量相等 | |
| C. | 乙醇和乙醚(CH3CH2OCH2CH3)互为同分异构体 | |
| D. | 乙炔与苯互为同系物 |
| A. | 气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 气体通过盛有足量溴水的洗气瓶 | |
| C. | 气体通过盛有足量蒸馏水的洗气瓶 | |
| D. | 气体与适量HCl混合 |
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴
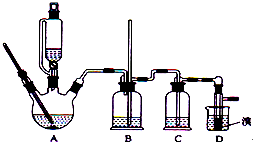 和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在发生反应前,分液漏斗使用前必须要检漏;在反应中,要加入沸石的作用是防暴沸,若加热后发现未加沸石,应采取的正确方法是:冷却后补加
(2)在装置B中安全管的作用原理是:当B压力过大时,安全管中液面上升,使B瓶中压力稳定
(3)判断该制各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应从下 口出(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用d洗涤除去;(填正确选项前的字母)
a.水 b.乙醇 c.碘化钠溶液 d.氢氧化钠溶液
发生的反应方程式为:2NaOH+Br2═NaBr+NaBrO+H2O
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发.
| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

实验步骤:①在烧杯中加入15mL 95%的乙醇和0.1g硼氢化钠,搅拌下,再滴入8mL苯乙酮,控制温
度在48℃~50℃,滴加完毕,室温下放置15min.
②在搅拌的条件下,慢慢滴加6mL 3mol/L的盐酸.
③水浴加热,使反应液中大部分乙醇蒸出,出现分层,再加入10mL乙醚.将混合反应液倒入分液漏
斗,分离上述液体,水层再用10mL乙醚萃取,合并两次分液得到的有机相.
④加入适量无水硫酸镁,静置片刻,过滤除去硫酸镁固体.再加入0.6g无水碳酸钾,然后进行简单蒸
馏除去乙醚.
⑤经减压蒸馏得到1-苯乙醇4.5g(减压蒸馏可降低有机物的沸点).
(1)反应中加入乙醇的目的是溶解硼氢化钠和苯乙酮,使反应物充分接触.
(2)反应完成后,蒸出大部分乙醇,反应液出现分层,上层为水层(填“水层”或“有机层”,下同),加入10mL乙醚,充分振荡后,上层为有机层.
(3)装置中仪器A的名称为蒸馏烧瓶,在本实验中最好选用的规格是50mL(填“50mL”、“100mL”或“200mL”);仪器B中冷凝水由a(填“a”或“b”)口流出.
(4)步骤④中加入无水硫酸镁的作用是干燥.
(5)步骤④蒸馏除去乙醚时,应采用的最佳加热方式为b(填字母序号)
a.酒精灯加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热.
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)>v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |

 $\stackrel{KOH}{→}$H-C≡
$\stackrel{KOH}{→}$H-C≡
 +H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团)
+H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团) ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.

 ;
; ;
;