题目内容
10.用Cu跟浓H2SO4反应,得到SO2的体积为22.4L(标准状况).把所得的CuSO4配制成500mL溶液.求:(1)反应过程中转移电子的物质的量.
(2)所得溶液中溶质的物质的量浓度.
分析 得到SO2的体积为22.4L,其物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,生成1mol的二氧化硫转移2mol的电子,根据c=$\frac{n}{V}$计算CuSO4的物质的量浓度,由此分析解答.
解答 解:(1)n(SO2)=$\frac{22.4L}{22.4L/mol}$=1 mol,生成1mol的二氧化硫转移2mol的电子,答:转移电子的物质的量2 mol;
(2)n(CuSO4)=n(SO2)=1 mol,所以c(CuSO4)=$\frac{1mol}{0.5L}$=2 mol/L,答:所得溶液中溶质的物质的量浓度为2 mol/L.
点评 本题考查化学方程式有关计算、物质的量有关计算,侧重考查学生对基础知识的巩固.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol乙醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8CHCl3中含有分子的数目为2NA | |
| C. | 1 mol-CH3中所含的电子总数为10 NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA |
1.某溶液既能溶解Al(OH)3,又能溶解H2SiO3的溶液,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO${\;}_{3}^{-}$、NO3- | B. | Na+、SO${\;}_{4}^{2-}$、Cl-、ClO- | ||
| C. | H+、Mg2+、SO${\;}_{4}^{2-}$、NO3- | D. | Ag+、K+、NO3-、Na+ |
5.据报道,科学家发现了新的氢粒子,这种粒子是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考.对于这种氢粒子,下列说法错误的是( )
| A. | 它的组成可以用H3+表示 | B. | 它比普通氢分子多一个氢原子核 | ||
| C. | 它一定含3个中子 | D. | 可以推测它的化学性质与H2不同 |
2.设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| B. | 17g的NH3分子中含有的电子数为10NA | |
| C. | 常温常压下,48g O3含有的氧原子数为3NA | |
| D. | 标准状况下,11.2LH2O中所含有的分子数为0.5NA |
16.下列叙述中不正确的是( )
| A. | 人类大规模开发、利用金属,铁比铝早 | |
| B. | 依据酸碱质子理论HCO3-是酸碱两性物质 | |
| C. | 因为铜比铁不活泼,所以铜与氯化铁溶液不会发生化学反应 | |
| D. | 煤燃烧前加入适量的石灰可以减少污染 |
17.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.0 L 1.0 mo1•L-1的NaAlO2 水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,3.6g H2O中含有电子数为2NA | |
| C. | 2.24LCO2中含有的原子数为0.3 NA | |
| D. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA |
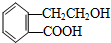 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 ;
;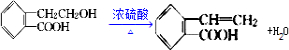 .
.