题目内容
 碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.(1)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确
(2)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.写出基态碳原子的电子排布图
(3)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是
(4)Fe(CO)5是一种常见的配合物,可代替四乙基铅作为汽油的抗爆震剂.
①写出CO的一种常见等电子体分子的结构式
②Fe(CO)5在一定条件下发生反应:Fe(CO)5(s)═Fe(s)+5CO(g),已知:反应过程中,断裂的化学键只有配位键,由此判断该反应所形成的化学键类型为
(5)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m.晶胞中两个Ni原子之间的最短距离为
考点:晶胞的计算,元素电离能、电负性的含义及应用,配合物的成键情况
专题:化学键与晶体结构
分析:(1)根据分子晶体的熔点与共价键的键能无关,
(2)根据电子排布规律,写出碳原子电子排布图;根据晶胞的分配原则计算出每个晶胞结构各离子的个数,
(3)根据同一周期,同一主族,元素电负性变化规律,比较元素电负性大小;根据每个硅原子最外层才满足8电子稳定结构,得出每个硅原子只有
个π键;
(4)①由等电子体定义可知CO的一种常见等电子体为氮气,CO为极性分子熔点高;
②断裂配位键后,配体变为CO,中心原子结合成金属晶体;
(5)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的
,晶胞面对角线则可由晶胞棱边长求得,根据NiXO中化合价代数和为零可求得晶体中Ni2﹢与Ni3﹢的最简整数比;
(2)根据电子排布规律,写出碳原子电子排布图;根据晶胞的分配原则计算出每个晶胞结构各离子的个数,
(3)根据同一周期,同一主族,元素电负性变化规律,比较元素电负性大小;根据每个硅原子最外层才满足8电子稳定结构,得出每个硅原子只有
| 1 |
| 2 |
(4)①由等电子体定义可知CO的一种常见等电子体为氮气,CO为极性分子熔点高;
②断裂配位键后,配体变为CO,中心原子结合成金属晶体;
(5)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的
| 1 |
| 2 |
解答:
解:(1)尽管C60中C-C键的键能可能大于金刚石,但其熔化时并不破坏化学键,因此比较键能没有意义,
故答案:不正确,C60是分子晶体,熔化时不需破坏化学键;
(2)碳原子的原子序数为6,其电子排布式: ; 在晶胞中,K原子和C60分子的个数比为(12÷2):(8÷8+1)=3:1,
; 在晶胞中,K原子和C60分子的个数比为(12÷2):(8÷8+1)=3:1,
故答案: ;3:1;
;3:1;
(3)同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30.
故答案:N>C>Si;30.
(4)①CO的等电子体为氮气,氮气的结构式为N≡N,对于相对分子质量相等的分子晶体而言,极性分子沸点高,CO为极性分子,氮气为非极性分子,CO的沸点高,
故答案为:N≡N;CO;
②此配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体,故答案为:金属键;
(5)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的
,由晶胞棱边长可求得晶胞面对角线为长为:
×4.28×10-10m,所以
×
×4.28×10-10m=3.03×10-10m,设晶体中Ni2﹢与Ni3﹢的最简整数比为x:y,根据NiXO中化合价代数和为零可知,
×0.88=2,由此解得x:y=8:3,故答案为:3.03×10-10;8:3;
故答案:不正确,C60是分子晶体,熔化时不需破坏化学键;
(2)碳原子的原子序数为6,其电子排布式:
 ; 在晶胞中,K原子和C60分子的个数比为(12÷2):(8÷8+1)=3:1,
; 在晶胞中,K原子和C60分子的个数比为(12÷2):(8÷8+1)=3:1,故答案:
 ;3:1;
;3:1;(3)同一周期,从左到右,电负性逐渐增大,同一主族,从上到下,电负性逐渐减小,因此,原子电负性由大到小的顺序是:N>C>Si,根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构.显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30.
故答案:N>C>Si;30.
(4)①CO的等电子体为氮气,氮气的结构式为N≡N,对于相对分子质量相等的分子晶体而言,极性分子沸点高,CO为极性分子,氮气为非极性分子,CO的沸点高,
故答案为:N≡N;CO;
②此配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体,故答案为:金属键;
(5)由于NiXO晶体晶胞结构为NaCl型,所以晶胞中两个Ni原子之间的最短距离为晶胞面对角线的
| 1 |
| 2 |
| 2 |
| 1 |
| 2 |
| 2 |
| 2x+3y |
| x+y |
点评:本题主要考查了电离能、电负性、电电子排布图、分子的空间构型、晶胞结构的计算等,试题涉及的知识点较多,学生做起来有些困难.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
常温下稀溶液中FeCl3水解方程式为Fe3++3H2O?Fe(OH)3+3H+,能使c(Fe3+)增大的是( )
| A、加入少量的H2SO4溶液 |
| B、加水稀释 |
| C、加热 |
| D、加入少量NaOH溶液 |
某温度下,可逆反应mA(g)+nB(g)?pC(g)的平衡常数为K,下列对K的说法正确的是( )
| A、若缩小反应器的容积,能使平衡正向移动,则K增大 |
| B、K值越大,表明该反应越有利于C的生成 |
| C、温度越高,K越大 |
| D、如果m+n=p,则K=1 |
下列气体可用同一装置制取和收集的是( )
| A、H2和SO2 |
| B、H2 和 C2H2 |
| C、NH3 和C2H4 |
| D、Cl2 和C2H4 |
下列叙述正确的是( )
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、 和 和 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH |
下列有关物质性质、应用的说法中正确的是( )
| A、SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物 |
| B、浓硫酸能干燥SO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、自来水厂可用明矾对水进行消毒杀菌 |
 目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
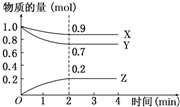 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答:
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试回答: