题目内容
2.下列仪器能直接用酒精灯加热的是( )①量筒②表面皿③烧杯④试管⑤烧瓶⑥蒸发皿⑦坩埚.
| A. | ②③④⑥⑦ | B. | ③④⑥⑦ | C. | ④⑥⑦ | D. | ②④⑦ |
分析 实验室中可直接加热的仪器有蒸发皿、试管、坩埚,垫石棉网可加热的有烧杯、烧瓶、锥形瓶等,不能加热的有量筒、表面皿、集气瓶、广口瓶、细口瓶等.
解答 解:①量筒、②表面皿是不能加热的仪器;
④试管、⑥蒸发皿、⑦坩埚为可直接加热的仪器;
给⑤烧瓶加热需要垫上石棉网,
故选C.
点评 本题考查常见仪器的使用,为高频考点,侧重考查学生的双基以及实验能力,注意能直接在酒精灯上加热的仪器,了解常见仪器的名称、用途、注意事项等是解答本题的关键.

练习册系列答案
相关题目
12. 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )| A. | 简单离子半径:Z>Y>X | |
| B. | 化合物P中只存在离子键 | |
| C. | 图示转化关系涉及的反应均为氧化还原反应 | |
| D. | 最简单气态氢化物的稳定性:W>X |
17.元素周期表中几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)<r(T2-)
④L2+和X2-的核外电子数相等.
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
①R的氧化物对应的水化物可能具有两性
②X单质可在氧气中燃烧生成XO3
③离子半径大小:r(M3+)<r(T2-)
④L2+和X2-的核外电子数相等.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ①②③ |
7.下列叙述正确的是( )
| A. | NaHCO3溶液中:c(H+)+c(Na+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)一样多 | |
| C. | 0.2mol•L-1 HCl溶液与等体积0.05 mol•L-1 Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 向10 mL 0.10mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
2.二氯化碳利用具有十分重要的意义,科学家有以下几个设想.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.
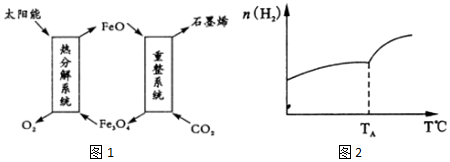
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
则反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数k=1.25×10-3.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.

(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
| Kb(NH3•H2O) | 2×10-5mol•L-1 |
| Ka1(H2CO3) | 4×10-7mol•L-1 |
| Ka2(H2CO3) | 4×10-11mol•L-1 |
19.有关如图所示有机化合物的说法不正确的是( )


| A. | 该有机物的分子式为C15H18O4 | |
| B. | 1 mol该化合物最多可以与2 mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |
20.除去乙酸乙酯中残留的乙酸和乙醇,有效的处理方法是( )
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和碳酸钠溶液洗涤后分液 | D. | 用过量氯化钠溶液洗涤后分液 |






 ,则①是E,②是D,③是A(填字母),其中装置E的作用是i观察气体的通入速率ⅱ混合氯气和氮气ⅲ除去氯气中的氯化氢
,则①是E,②是D,③是A(填字母),其中装置E的作用是i观察气体的通入速率ⅱ混合氯气和氮气ⅲ除去氯气中的氯化氢