题目内容
1. A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:(1)A、B、C的第一电离能由小到大的顺序是C<O<N(用对应的元素符号表示);基态D原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1.
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取sp2杂化;BC${\;}_{3}^{-}$的空间构型为平面三角形(用文字描述).
(3)1mol AB-中含有的π键数目为2NA.
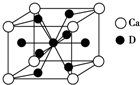
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是1:5.
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g/cm3.
分析 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大;第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A是C元素;C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构,且原子序数大于A而小于C,则B是N元素;
D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D是Cu元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
基态D原子核外有29个电子,根据构造原理书写基态D原子的简化电子排布式;
(2)A的最高价氧化物对应的水化物是H2CO3,该分子中中心原子C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式及碳酸根离子空间构型;
(3)CN-与N2互为等电子体,则每个CN-中含有2个π键,据此计算1mol CN-中含有的π键个数;
(4)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,利用均摊法计算Ca、Cu原子个数之比;
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,根据Ca、Cu合金确定该镧镍合金中n值;其密度=$\frac{\frac{M}{N{\;}_{A}}}{V}$.
解答 解:A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大;第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A是C元素;C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构,且原子序数大于A而小于C,则B是N元素;
D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D是Cu元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O元素第一电离能从小到大顺序是C<O<N;
基态D原子核外有29个电子,根据构造原理书写基态Cu原子的简化电子排布式为[Ar]3d104s1,
故答案为:C<O<N;[Ar]3d104s1;
(2)A的最高价氧化物对应的水化物是H2CO3,该分子中中心原子C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式为sp2,碳酸根离子空间构型为平面三角形,
故答案为:sp2;平面三角形;
(3)CN-与N2互为等电子体,则每个CN-中含有2个π键,则1mol CN-中含有的π键个数为2NA,
故答案为:2NA;
(4)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,该晶胞中Ca原子个数=8×$\frac{1}{8}$=1、Cu原子个数=8×$\frac{1}{2}$+1=5,则Ca、Cu原子个数之比为1:5,
故答案为:1:5;
(5)Ca、Cu合金化学式为CaCu5,镧镍合金与上述合金都具有相同类型的晶胞结构XYn,所以该镧镍合金中n=5;
该物质密度═$\frac{\frac{M}{N{\;}_{A}}}{V}$=$\frac{\frac{4.5}{N{\;}_{A}}}{9.0×10{\;}^{-23}}$g/cm3=0.083 g/cm3,
故答案为:5;0.083g/cm3.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布等知识点,侧重考查学生分析计算及空间想象能力,难点是晶胞计算,题目难度中等.

| A. | 碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3- HCO3-?H++CO32- | |
| B. | 偏铝酸钠的水解方程式为:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑ | |
| D. | 醋酸铵的水解方程式为:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O |
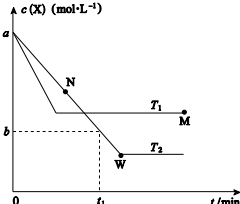 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )| A. | 该反应进行到M 点放出的热量大于进行到W 点放出的热量 | |
| B. | T2 下,在0~t1 时间内,v(Y)═$\frac{a-b}{{t}_{1}}$mol•L-1•min-1 | |
| C. | M 点的平衡常数小于W 点的平衡常数 | |
| D. | M 点时再加入一定量X,平衡后X 的转化率减小 |
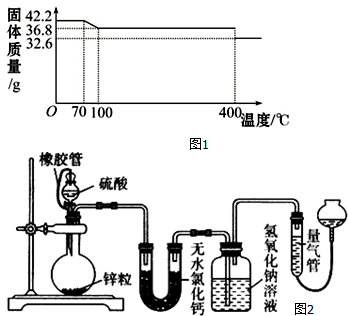
(1)试确定150℃时固体物质的化学式为K4[Fe(CN)6].
(2)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a>0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=(100a-1)×10-7 mol•L-1.
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O═2H2SO4的转化.已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(4)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图2装置进行实验(实验时压强为10lkPa,温度为0℃).
(Ⅰ)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中n(H2)=(cV-$\frac{m}{32}$)mol(用含字母的代数式表示).若撤走盛有无水氯化钙的U型管,n(SO2):n(H2)的数值将偏大(填偏大、偏小或无影响)
(Ⅱ)在硫酸中加入硫酸铜可以加快氢气的生成速率的原因:锌和铜构成原电池,加快反应速率
(Ⅲ)为进一步探究硫酸铜的量对氢气生成速率的影响,某同学设计如下一系列实验,将表中所给的混合溶液分别加入到5个盛有过量Zn粒的反应瓶中.
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
②为探究氢气生成速率要收集产生的气体,还需记录:收集等体积气体所需时间.

下列说法不正确的是( )
| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲加热、蒸发、灼烧也可得到24.0g固体 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
| A. |  海水蒸馏得到淡水 | |
| B. |  中和滴定 | |
| C. |  苯萃取碘水中I2,分出水层后的操作 | |
| D. |  制备乙酸乙酯 |
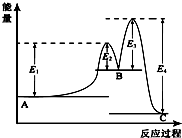
| A. | A?B的反应热△H=+(E2-E1)KJ/mol | |
| B. | 三种化合物中A最稳定 | |
| C. | C?B是放热反应 | |
| D. | 催化剂是要参与化学反应的,使用合适的催化剂可以降低反应所需要的活化能 |
