题目内容
19.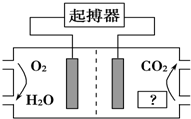 如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )
如图所示,最近美国医学家利用人体自身环境设计了心脏起搏器,其动力由人体体液中的能量物质提供.下列有关说法正确的是( )| A. | 图中“?”为人体中的脂肪 | |
| B. | O2极为心脏起搏器的负极 | |
| C. | 产生的CO2使人体血液呈酸性,长期使用对人体有害 | |
| D. | 电池正极的电极反应式为O2+4H++4e-═2H2O |
分析 A.给人体提供能量的是葡萄糖而不是脂肪;
B.该原电池中,通入氧气的电极是正极,则生成二氧化碳的电极是负极;
C.人体有调节酸碱性的功能;
D.正极上氧气得电子和氢离子反应生成水.
解答 解:A.人体提供能量的是葡萄糖而不是脂肪,故A错误;
B.原电池放电时,葡萄糖失电子发生氧化反应,所以葡萄糖电极为起搏器的负极,氧气的电极为起搏器的正极,故B错误;
C.人体有调节功能,通过人体调节不会使人体呈酸性,故C错误;
D.电池正极上氧气得电子和水反应生成氢氧根离子,所以正极上的电极反应式为O2+2H20+4e-═4OH-,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,正确判断正负极及正确书写电极反应式是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,题目难度不大.

练习册系列答案
相关题目
7.下列物质属于氧化物的是( )
| A. | 水蒸气 | B. | 氯化钠 | C. | 硫酸 | D. | 氢氧化钠 |
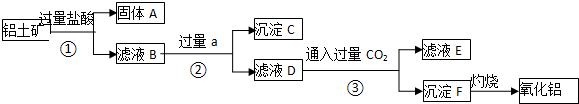
14.面对日益严重的资源短缺及环境污染问题,“变废为宝”成为化学发展的新方向.废旧酸性锌锰干电池经分离破碎后的锰粉含Mn02、Mn0(0H)、Zn(NH3)CL2、Fe、NH4C1和炭黑等,可用于制取Mn02高性能磁性材料MnC03,其工艺流程如下:
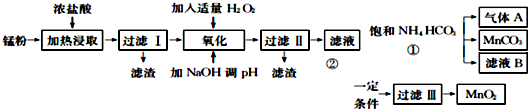
已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.

已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.
6.下列有关物质的检验或区分方法中不正确的是( )
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 根据纤维在火焰上燃烧产生的气味,可确定该纤维是否为蛋白质纤维 | |
| C. | 两份常温下均为饱和溶液(一份是NaOH溶液,一份是氢氧化钙溶液),上述两份饱和溶液可通过加入少量的NaOH固体而鉴别出 | |
| D. | 某矿石中加入足量的盐酸,根据放出的二氧化碳气体,可证明该矿石一定含有碳酸盐 |
 钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.