题目内容
15.第一电离能I1是指气态原子(g)失去一个电子成为气态阳离子X+(g)所需的最低能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.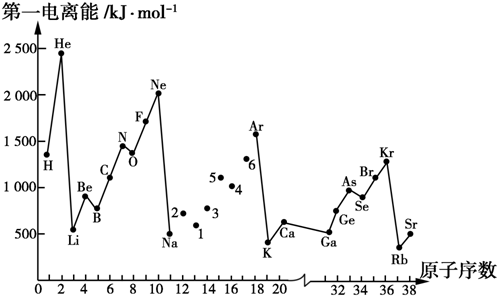
请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间的元素用短线连接起来,构成完整的图象.
(2)从图中分析可知,同一主族元素原子的第一电离子能I1的变化规律是从上到下依次减小.
(3)图中5号元素在周期表中的位置是第三周期,ⅤA族.
(4)图中4、5、6号三种元素的气态氢化物的化学式分别为H2S、PH3、HCl.
(5)图中1~6号元素中,最高价氧化物对应水化物中酸性最强的是HClO4,两性化合物有Al2O3、Al(OH)3.
分析 (1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)同一主族元素原子的第一电离能I1,从上到下依次减小;
(3)5元素为15号元素氮,在周期表中氮的位置为第三周期,第ⅤA族;
(4)根据第一电离能,同周期从左向右整体呈增大趋势,但第ⅡA>ⅢA,ⅤA>ⅥA特殊,所以图中4、5、6号三种元素分别为S、P、Cl,据此书写氢化物;
(5)根据1~6号元素中,6号为Cl为非金属性最强,所以最高价氧化物对应水化物中酸性最强,呈两性的元素为Al,据此解答.
解答 解:(1)根据图片知,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以Na~Ar之间的元素用短线连接起来的图象为 ;故答案为:
;故答案为: ;
;
(2)同一主族元素原子的第一电离能I1,如上图以第ⅠA族为例,变化规律从上到下依次减小,其他族一致;故答案为:从上到下依次减小;
(3)5号元素为15号元素氮,在周期表中的位置为第三周期,第ⅤA族;故答案为:第三周期,ⅤA族;
(4)根据第一电离能,同周期从左向右整体呈增大趋势,但第ⅡA>ⅢA,ⅤA>ⅥA特殊,所以图中4、5、6号三种元素分别为S、P、Cl,则对应的氢化物分别为:H2S、PH3、HCl,故答案为:H2S、PH3、HCl;
(5)根据1~6号元素中,6号为Cl为非金属性最强,所以最高价氧化物对应水化物HClO4酸性最强,呈两性的元素为Al,则两性化合物有Al2O3、Al(OH)3,故答案为:HClO4;Al2O3、Al(OH)3.
点评 本题考查了第一电离能的变化趋势,难度不大,注意“同一周期元素中,元素第一电离能的变化趋势,及异常现象”,为易错点.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | CH3C(CH3)2OH | B. | CH3CHOHCH(CH3)CH3 | ||
| C. | CH3CH2CH2CHOHCH3 | D. | CH3CH2CHOHCH2CH3 |
| A. | Mg、Al、B | B. | N、O、S | C. | Li、Be、Mg | D. | B、F、Cl |
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液只能与酸反应 | |
| B. | 丁和甲中各元素质量比相同,则丁中一定含有-l价的元素 | |
| C. | 丙中含有第二周期ⅣA族的元素,则丙一定是只含C、H的化合物 | |
| D. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| A. | (CH3CH2)3CCH2Cl | B. | CH3Cl | C. | 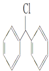 | D. | 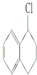 |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
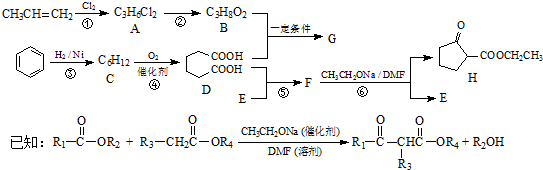
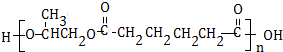 .
.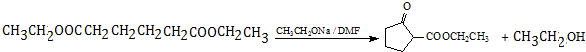 .
.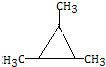 .
. 名称:3-甲基-4-乙基-辛烷
名称:3-甲基-4-乙基-辛烷