题目内容
10.A、B、C是周期表中相邻的三种元素,A和B是同周期,B和C同主族,三种元素最外层电子总数之和为17,核内质子数之和为31,则A、B、C三种元素是( )| A. | Mg、Al、B | B. | N、O、S | C. | Li、Be、Mg | D. | B、F、Cl |
分析 A和B同周期,B和C同主族,设A元素的最外层电子数为x,则B、C最外层电子数为x+1或x-1,若B、C元素的最外层电子数为x+1,则x+2(x+1)=17,解得x=5,符合题意;若B、C元素的最外层电子数为x-1,则有x+2(x-1)=17,解得x=$\frac{19}{3}$,不符合题意,即A处于ⅤA族,B、C处于ⅥA族.三种元素质子数总和为31,平均质子数=$\frac{31}{3}$=10.3,一定有元素处于第二周期,故三元素处于短周期,可以确定B、C为O元素、S元素,进而计算A的质子数,确定A、B、C元素.
解答 解:A和B同周期,B和C同主族,设A元素的最外层电子数为x,则B、C最外层电子数为x+1或x-1,若B、C元素的最外层电子数为x+1,则x+2(x+1)=17,解得x=5,符合题意;若B、C元素的最外层电子数为x-1,则有x+2(x-1)=17,解得x=$\frac{19}{3}$,不符合题意,即A处于ⅤA族,B、C处于ⅥA族.三种元素质子数总和为31,平均质子数=$\frac{31}{3}$=10.3,一定有元素处于第二周期,故三元素处于短周期,可以确定B、C为O元素、S元素,故A的质子数为31-8-16=7,则A为N元素,由于A与B同周期,故B为O元素、C为S元素,故选B.
点评 本题考查原子结构与位置关系,难度中等,关键是根据三种元素位置关系结合质子数总和为31、最外层电子数之和为17,确定元素所在的周期和主族,注意掌握短周期元素的特点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列有关FeBr2溶液的叙述错误的是( )
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO42-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
1.元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是( )
| A. | 第1列中的碱金属和第17列元素的单质熔、沸点变化趋势相同 | |
| B. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| C. | 在整个18列元素中,第14列元素形成的化合物种类最多 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
18.下列烷烃分子中的一个氢原子被氯原子取代后,不能产生同分异构体的是( )
| A. | 戊烷 | B. | 2,2-二甲基丙烷 | C. | 异丁烷 | D. | 异戊烷 |
19.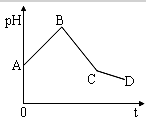 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
 将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | 整个过程中阳极先产生Cl2,后产生O2 | |
| D. | CD段表示的电解过程中水的电离被促进 |
1.已知A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)A有8、9、10个中子的三种核素,它们之间称同位素,B在元素周期表的位置:第二周期VA族,B的氢化物水溶液显碱性的原因NH3+H2O=NH3•H2O=NH4++OH-.
(2)C的原子结构示意图为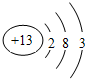 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).