题目内容
15.下列分子的立体结构模型正确的是( )| A. | CO2的立体结构模型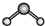 | B. | PH3的立体结构模型 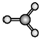 | ||
| C. | H2S的立体结构模型 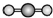 | D. | CH4的立体结构模型 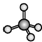 |
分析 根据价电子对互斥理论确定分子的立体结构模型,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;
A.二氧化碳为直线型;B.磷化氢为三角锥型;C.硫化氢为V型;D.甲烷为正四面体型.
解答 解:A.二氧化碳分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,不含孤电子对,所以空间构型是直线形,不是V型,故A错误;
B.PH3分子中P原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,含有一个孤电子对,所以其空间构型为三角锥型,不是平面三角形,故B错误;
C.H2S分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,含有2个孤电子对,实际上其空间构型是V型,是直线型,故C错误;
D.CH4分子中中心原子C原子原子价层电子对个数=σ键个数+孤电子对个数=4+$\frac{1}{2}$(4-1×4)=4,中心原子不含有孤电子对,分子构型为正四面体结构,故D正确;
故选D.
点评 本题考查分子的立体结构模型,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错点,题目难度不大.

练习册系列答案
相关题目
4.下列变化中不属于氮的固定的是( )
| A. | 工业上将NH3与CO2在高温高压下制成[CO(NH2)2] | |
| B. | 空气中的O2和N2在闪电时化合成NO | |
| C. | 豆科植物的根瘤菌把氮气变为NH3 | |
| D. | 工业上用N2和H2来合成NH3 |
5.下列表示物质结构的化学用语或模型图正确的是( )
| A. | H2O2的结构式:H-O-O-H | B. | C2H4的结构简式:CH2CH2 | ||
| C. | O2-结构示意图: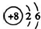 | D. | CCl4的结构式: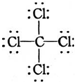 |
3.对0.10mol/L的碳酸钠溶液加热,利用传感器测定溶液的pH,结果如图所示,下列对实验结果的分析不正确的是( )
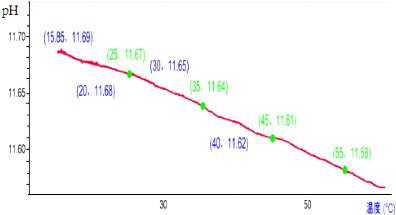

| A. | 随着温度升高溶液中c(OH-)不断减小 | |
| B. | 加热促进CO32-水解和水的电离,溶液中c(OH-)随温度升高而增大 | |
| C. | 溶液pH减小的原因是:加热促进水的电离,Kw随温度升高而增大 | |
| D. | 25℃时CO32-的水解程度约为100.67% |
20.某学生配制了100mL 1mol/L的硫酸溶液,在配制过程中,下列操作可能导致溶液浓度偏低的是( )
①定容时仰视刻度线
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切.
①定容时仰视刻度线
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切.
| A. | ②③④ | B. | ③④ | C. | ①②③④ | D. | ①②③ |
4.下列叙述正确的是( )
| A. | 1克氢气的物质的量是1mol | |
| B. | 1.12升氢气为0.05mol | |
| C. | NaCl晶体中Na+、Cl- 的个数之比为1:1 | |
| D. | Cl2摩尔质量为71克 |
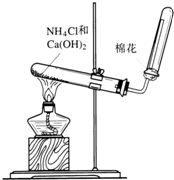 如图是实验室制取氨气的装置图.请回答:
如图是实验室制取氨气的装置图.请回答: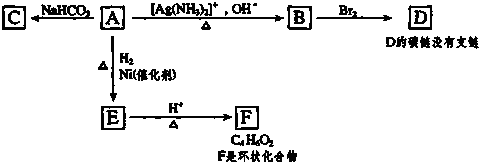
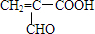 ;
;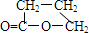 ,由E生成F的反应类型是酯化反应.
,由E生成F的反应类型是酯化反应.