题目内容
(1)常温时,四种溶液:Ⅰ.pH=4的CH3COOH溶液;Ⅱ.pH=4的HCl溶液;Ⅲ.pH=10的NaOH溶液;Ⅳ.pH=10的CH3COONa溶液.
①Ⅲ和Ⅳ的溶液中水电离的c(H+)浓度之比 .
②下列有关叙述正确的是 .
A.Ⅱ、Ⅲ的溶液分别与10g铝粉反应,生成H2的量Ⅲ更多
B.Ⅰ与Ⅱ等体积混合后,溶液中的c(CH3COO-)为原溶液浓度的1/2
C.将Ⅰ和Ⅲ等体积混合后,溶液pH小于7
D.四种溶液各10mL分别加水稀释至100mL后,溶液的pH:Ⅲ>Ⅳ>Ⅰ>Ⅱ
(2)CH3COOH溶液的Ka=1.6×10-5,则1.0mol/L的CH3COONa溶液中c(OH-)= .
(3)将CO2通入NaOH溶液中,回答下列问题.
①当CO2与NaOH物质的量之比为1:2时,溶液中离子浓度的大小顺序为 .
②当c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)时,反应后溶液中的溶质为 .
(4)用NaOH溶液滴定醋酸溶液的过程中,锥形瓶中的溶液其离子浓度关系有如下式子,在滴定过程中这些式子出现的先后顺序为 请选出正确的顺序)
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ②c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
③c(CH3COO-)>c(H+)=c(Na+)>c(OH-) ④c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
⑤c(CH3COO-)>c(H+)>c(Na+)>c(OH-) ⑥c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
⑦c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
A、⑦④①⑥②③⑤B、⑤②③①⑥④⑦C、③⑤②①⑥④⑦D、⑤③②⑥①④⑦
①Ⅲ和Ⅳ的溶液中水电离的c(H+)浓度之比
②下列有关叙述正确的是
A.Ⅱ、Ⅲ的溶液分别与10g铝粉反应,生成H2的量Ⅲ更多
B.Ⅰ与Ⅱ等体积混合后,溶液中的c(CH3COO-)为原溶液浓度的1/2
C.将Ⅰ和Ⅲ等体积混合后,溶液pH小于7
D.四种溶液各10mL分别加水稀释至100mL后,溶液的pH:Ⅲ>Ⅳ>Ⅰ>Ⅱ
(2)CH3COOH溶液的Ka=1.6×10-5,则1.0mol/L的CH3COONa溶液中c(OH-)=
(3)将CO2通入NaOH溶液中,回答下列问题.
①当CO2与NaOH物质的量之比为1:2时,溶液中离子浓度的大小顺序为
②当c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)时,反应后溶液中的溶质为
(4)用NaOH溶液滴定醋酸溶液的过程中,锥形瓶中的溶液其离子浓度关系有如下式子,在滴定过程中这些式子出现的先后顺序为
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ②c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
③c(CH3COO-)>c(H+)=c(Na+)>c(OH-) ④c(Na+)>c(CH3COO-)=c(OH-)>c(H+)
⑤c(CH3COO-)>c(H+)>c(Na+)>c(OH-) ⑥c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
⑦c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
A、⑦④①⑥②③⑤B、⑤②③①⑥④⑦C、③⑤②①⑥④⑦D、⑤③②⑥①④⑦
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:(1)①NaOH抑制水的电离,CH3COONa水解促进水的电离,结合pH计算;
②A.酸和碱与金属铝反应产生氢气的量得根据酸碱的物质的量的多少而定;
B.醋酸是弱酸,电离过程是可逆的,氢离子的存在对其电离起到抑制作用;
C.根据醋酸和氢氧化钠混合以后溶液的组成情况来确定溶液的酸碱性;
D.根据强酸、强碱、弱酸、弱碱加水稀释后pH的变化来确定;
(2)醋酸的电离平衡常数表达式Ka=
,Kh=
,根据Ka=
=
=
计算;
(3)①当CO2与NaOH物质的量之比为1:2时,反应生成Na2CO3;
②当c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)时,根据物料生成可知应生成NaHCO3;
(4)用NaOH溶液滴定醋酸溶液的过程中,开始溶液呈酸性,随着氢氧化钠的滴加,溶液酸性逐渐减弱,分别至中性、碱性,以此解答.
②A.酸和碱与金属铝反应产生氢气的量得根据酸碱的物质的量的多少而定;
B.醋酸是弱酸,电离过程是可逆的,氢离子的存在对其电离起到抑制作用;
C.根据醋酸和氢氧化钠混合以后溶液的组成情况来确定溶液的酸碱性;
D.根据强酸、强碱、弱酸、弱碱加水稀释后pH的变化来确定;
(2)醋酸的电离平衡常数表达式Ka=
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
| c(OH-)?c(CH3COOH) |
| c(CH3COO-) |
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
| cc(OH-)?(H+) | ||
|
| Kw |
| Kh |
(3)①当CO2与NaOH物质的量之比为1:2时,反应生成Na2CO3;
②当c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)时,根据物料生成可知应生成NaHCO3;
(4)用NaOH溶液滴定醋酸溶液的过程中,开始溶液呈酸性,随着氢氧化钠的滴加,溶液酸性逐渐减弱,分别至中性、碱性,以此解答.
解答:
解:(1)①NaOH抑制水的电离,溶液中水电离的c(H+)浓度为1×10-10mol?L-1,
CH3COONa水解促进水的电离,溶液中水电离的c(H+)浓度为1×10-6mol?L-1,
①Ⅲ和Ⅳ的溶液中水电离的c(H+)浓度之比10-6,故答案为:10-6;
②A.盐酸、氢氧化铝与金属铝反应产生氢气的量和酸、碱的物质的量有关、如果酸碱都是过量的,产生氢气一样,但是酸碱少量时,得根据酸碱的物质的量来计算氢气的量,需要知道其体积的大小,故A错误;
B.Ⅰ与Ⅱ等体积混合后,溶液中氢离子浓度不变,醋酸分子和醋酸根离子浓度减小为一半,则平衡向逆向移动,溶液中的c(CH3COO-)不足原溶液浓度的一半,故B错误;
C、pH=4的CH3COOH溶液和pH=10的NaOH溶液混合以后,醋酸剩余,溶液显示酸性,溶液pH一定小于7,故C正确;
D、Ⅰ.pH=4的CH3COOH溶液加水稀释为原来的10倍后,pH由4变为大于4小于5的一个值;Ⅱ.pH=4的HCl溶液加水稀释为原来的10倍后,pH由4变为5;Ⅲ.pH=10的NaOH溶液加水稀释为原来的10倍后,pH由10变为9;Ⅳ.pH=10的CH3COONa溶液加水稀释为原来的10倍后,pH由10变为大于9小于10的一个值,所以溶液的pH:Ⅳ>Ⅲ>Ⅱ>Ⅰ,故D错误.
故答案为:C;
(2)Ka=
=
=
,则Kh=
=
,c(OH-)=
=
=2.5×10-5(mol?L-1),
故答案为:2.5×10-5mol?L-1;
(3)①当CO2与NaOH物质的量之比为1:2时,反应生成Na2CO3,水解呈碱性,且第一步水解大于第二步水解,离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
②当c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)时,根据物料生成可知应生成NaHCO3,故答案为:NaHCO3;
(4)用NaOH溶液滴定醋酸溶液的过程中,开始溶液呈酸性,随着氢氧化钠的滴加,溶液中首先出现c(CH3COO-)>c(H+)>c(Na+),溶液酸性逐渐减弱,随着氢氧化钠的滴加,出现c(CH3COO-)>c(H+)=c(Na+)>c(OH-),当溶液呈中性时为c(Na+)=c(CH3COO-)>c(OH-)=c(H+),碱过量时为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),
故答案为:D.
CH3COONa水解促进水的电离,溶液中水电离的c(H+)浓度为1×10-6mol?L-1,
①Ⅲ和Ⅳ的溶液中水电离的c(H+)浓度之比10-6,故答案为:10-6;
②A.盐酸、氢氧化铝与金属铝反应产生氢气的量和酸、碱的物质的量有关、如果酸碱都是过量的,产生氢气一样,但是酸碱少量时,得根据酸碱的物质的量来计算氢气的量,需要知道其体积的大小,故A错误;
B.Ⅰ与Ⅱ等体积混合后,溶液中氢离子浓度不变,醋酸分子和醋酸根离子浓度减小为一半,则平衡向逆向移动,溶液中的c(CH3COO-)不足原溶液浓度的一半,故B错误;
C、pH=4的CH3COOH溶液和pH=10的NaOH溶液混合以后,醋酸剩余,溶液显示酸性,溶液pH一定小于7,故C正确;
D、Ⅰ.pH=4的CH3COOH溶液加水稀释为原来的10倍后,pH由4变为大于4小于5的一个值;Ⅱ.pH=4的HCl溶液加水稀释为原来的10倍后,pH由4变为5;Ⅲ.pH=10的NaOH溶液加水稀释为原来的10倍后,pH由10变为9;Ⅳ.pH=10的CH3COONa溶液加水稀释为原来的10倍后,pH由10变为大于9小于10的一个值,所以溶液的pH:Ⅳ>Ⅲ>Ⅱ>Ⅰ,故D错误.
故答案为:C;
(2)Ka=
| c(CH3COO-)c(H+) |
| c(CH3COOH) |
| cc(OH-)?(H+) | ||
|
| Kw |
| Kh |
| c(OH-)?c(CH3COOH) |
| c(CH3COO-) |
| Kw |
| Ka |
|
|
故答案为:2.5×10-5mol?L-1;
(3)①当CO2与NaOH物质的量之比为1:2时,反应生成Na2CO3,水解呈碱性,且第一步水解大于第二步水解,离子浓度大小顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
②当c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)时,根据物料生成可知应生成NaHCO3,故答案为:NaHCO3;
(4)用NaOH溶液滴定醋酸溶液的过程中,开始溶液呈酸性,随着氢氧化钠的滴加,溶液中首先出现c(CH3COO-)>c(H+)>c(Na+),溶液酸性逐渐减弱,随着氢氧化钠的滴加,出现c(CH3COO-)>c(H+)=c(Na+)>c(OH-),当溶液呈中性时为c(Na+)=c(CH3COO-)>c(OH-)=c(H+),碱过量时为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),
故答案为:D.
点评:本题考查较为综合,涉及酸碱混合的计算和判断,弱电解质的电离的知识,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握电解质的电离特点和相关计算公式的运用,难度中等.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
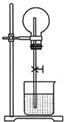 如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )
如图为中学化学教材上的喷泉实验装置.在烧瓶中充满了干燥气体,胶头滴管及烧瓶中分别盛有液体,下列各组中能形成这样喷泉但液体不能充满烧瓶的是( )| A、NH3 |
| B、NO2和H2O |
| C、CO2和NaOH溶液 |
| D、4:1的NO2与O2和水 |
生物学家借助新的显微技术,成功观察到小于20nm的微粒.下列分散系中分散质粒子直径最小的是 (1nm=1x10-9m)( )
| A、雾 |
| B、氢氧化铁胶体 |
| C、石灰乳 |
| D、KNO3溶液 |

