题目内容
16.下列实验装置正确且能达到实验目的是( )
| A. | 甲装置:测定盐酸的物质的量浓度 | |
| B. | 乙装置:验证H2SO4、H2CO3、H2SiO3酸性的强弱 | |
| C. | 丙装置:实验室制备乙酸乙酯 | |
| D. | 丁装置:比较碳酸钠和碳酸氢钠的热稳定性 |
分析 A.NaOH溶液应该盛放在碱式滴定管中;
B.强酸能和弱酸盐反应生成弱酸;
C.制取乙酸乙酯时导气管不能伸入饱和碳酸钠溶液中;
D.比较碳酸钠和碳酸氢钠的热稳定性时,应该将碳酸氢钠放置在温度较低位置.
解答 解:A.碱式滴定管只能盛放碱性溶液、酸式滴定管只能盛放酸性溶液,所以NaOH溶液应该盛放在碱式滴定管中,故A错误;
B.强酸能和弱酸盐反应生成弱酸,稀硫酸和碳酸钠反应生成二氧化碳、水,二氧化碳、水和硅酸钠反应生成硅酸沉淀,所以可以根据实验现象判断酸性强弱,能实现实验目的,故B正确;
C.制取乙酸乙酯时导气管不能伸入饱和碳酸钠溶液中,否则易引起倒吸,应该将导气管放置在刚好接触饱和碳酸钠溶液位置,且加热时应该用外焰加热,不能用焰心加热,故C错误;
D.比较碳酸钠和碳酸氢钠的热稳定性时,应该将碳酸氢钠放置在温度较低位置,所以碳酸钠和碳酸氢钠位置应该互换,在较低温度下碳酸氢钠分解说明碳酸氢钠稳定性不如碳酸钠,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质稳定性强弱判断、物质制备、酸性强弱判断、仪器的使用等知识点,明确实验原理及实验基本操作方法、仪器用途等知识点是解本题关键,注意从实验操作规范性及实验原理分析解答,题目难度不大.

练习册系列答案
相关题目
6.下列有关说法中正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 水中的溶解度:Na2CO3<NaHCO3 | ||
| C. | 铜与硫磺反应生成硫化铜 | D. | 氨气与氯化氢气体反应生成白雾 |
7.品红分子结构中的发色基团遇到SO2与水形成的亚硫酸后结构发生改变,生成不稳定的无色化合物.亚硫酸漂白原理可用下面的反应方程式表示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 品红的分子式为C20H18N3 | |
| B. | 上述漂白原理反应属加成反应 | |
| C. | 碱性品红及与H2SO3生成的无色化合物都可与NaOH溶液反应 | |
| D. | 该无色化合物受热容易分解 |
8.下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 水玻璃中通入过量二氧化碳气体:SiO32-+CO2+H2O═H2SiO3+CO32- | |
| C. | 浓烧碱溶液中加入铝片:Al+OH-+H2O═AlO2-+H2↑ | |
| D. | NaHSO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
5.常温下,将体积均为10mL,pH均为11的 NaOH和CH3COONa溶液加水稀释,pH变化如图所示,下列结论正确的是( )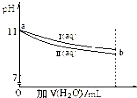

| A. | I 和 II 溶液中,离子种类数相同 | |
| B. | a 点处,I 溶液的浓度为 10-3mol?L-1 | |
| C. | a 点处,I、II 对水的电离平衡影响相同 | |
| D. | b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多 |
6.某相对分子质量尚未确定的有机物,其的红外光谱图上发现有O-H键、C-H键、C-O键的振动吸收,则该有机物可能是( )


| A. | 乙醇 | B. | 乙醚 | C. | 正丙醇 | D. | 丙烯 |