题目内容
将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
A.0.3mol NO2 和0.3mol NO
B.0.2mol NO2和0.2mol N2O4
C.0.1mol NO、0.2mol NO2和0.05mol N2O4
D.0.6mol NO
BC
【解析】
试题分析:Mg—Cu混合物完全溶解于足量的硝酸中,失去电子产生Mg2+、Cu2+,硝酸得到电子变为x气体,向反应后的溶液中加入适量的NaOH溶液,产生21.4g沉淀,n(OH-)=(21.4g—11.2g)÷17g/mol=0.6mol。金属阳离子结合的OH-的个数与金属失去电子的物质的量相等,也就等于硝酸得到电子的物质的量。
A.若产生0.3mol NO2 和0.3mol NO,则得到电子的物质的量是0.3mol×1+0.3mol×3=1.2mol>0.6mol,错误;
B.若产生0.2mol NO2和0.2mol N2O4,则得到电子的物质的量是0.2mol×1+0.2mol×2×1=0.6mol,正确;
C.若产生0.1mol NO、0.2mol NO2和0.05molN2O4,
则得到电子的物质的量是0.1mol×3+0.2mol×1+0.05mol×2×1=0.6mol,正确;
D.若产生0.6mol NO,则得到电子的物质的量是0.6mol×3=1.8mol>0.6mol,错误。
考点:考查守恒方法在氧化还原反应方程式计算中的应用的知识。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
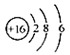
 。它的一氯代物有 种。
。它的一氯代物有 种。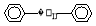 ,试再写出另一种的结构简式____________。
,试再写出另一种的结构简式____________。

 3C+4D中,下列表示该反应速率最快的是
3C+4D中,下列表示该反应速率最快的是