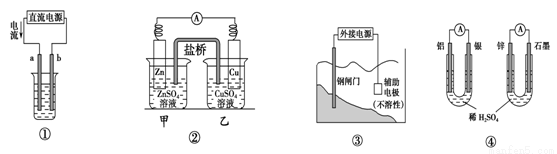
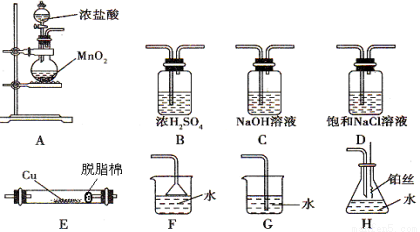
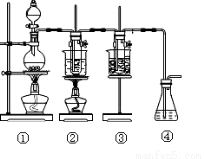
题目内容
在0.5 L某浓度的Na2SO4溶液中含有0.5 mol Na+,对该溶液的说法不正确的是
A.该溶液的物质的量浓度为1 mol·L—1
B.该溶液中含有35.5 g Na2SO4
C.配制100 mL该溶液需用7.1 g Na2SO4
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
A
【解析】
试题分析:含有0.5 mol Na+,所以含有Na2SO4 0.25mol;该溶液的物质的量浓度为0.25mol ÷0.5L=0.5 mol·L—1,故A错误;Na2SO4的质量为0.25mol×142g/mol=35.5g,故B正确;配制100 mL该溶液需用7.1 g Na2SO4的质量为m=cvM=7.1g,故C正确;0.5 L Na2SO4溶液中含有0.5 mol Na+,100 mL该溶液中 Na+的物质的量为0.1 mol,故D正确。
考点:本题考查物质的量浓度。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(10分)请回答下列问题:
(1)CH4和H2O在催化剂表面发生反应CH4+H2O(g)? CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
温度/℃ | 800 | 1 000 | 1 200 | 1 400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1 771.5 |
①该反应是________(填“吸热”或“放热”)反应
②T ℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.5 mol·L-1,计算该温度下CH4+H2O(g) CO+3H2的平衡常数K=______,该温度下达到平衡时H2的平均生成速率为_______________
CO+3H2的平衡常数K=______,该温度下达到平衡时H2的平均生成速率为_______________
(2)常温下,取pH=2的盐酸和醋酸各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1,醋酸中加入的Zn粒质量为m2。则m1________m2(填“<”、“=”或“>”)。