题目内容
非金属元素及其化合物在国民生产中占有重要的地位,下面是对几种非金属元素及其化合物的研究,按要求回答问题:
I.(1)氧族元素位于元素周期表的第 族,包括O、S、 、Te、Po(填写元素符号).
(2)写出氧族元素中含有18个电子的两种氢化物的电子式: .
(3)一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L.
①下列能说明反应达到平衡状态的是
A.v(O2)正=2v(SO3)逆
B.气体的平均相对分子质量不变
C.气体的密度不变
D.气体的分子总数不变
②从反应开始到平衡,用SO2的浓度变化表示的反应速率为 .
③该温度下,此反应的化学平衡常数为 .
④若向平衡体系中再加入4molSO2和2molO2,化学平衡 移动(填“向右”、“向左”或“不”),再次达到平衡时SO2的转化率 .(填“增大”、“减小”或“不变”).(结果保留两位小数)
Ⅱ.(1)已知:HF(aq)与NaOH( aq)反应的△H=一67.7kJ/mol; HCl(aq)与NaOH(aq)反应的△H=-57.3kJ/mol.则HF(aq)?H+(aq)+F-(aq)△H= .
(2)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,先生成沉淀(填化学式),当两种沉淀共存时,c(Br-)与c(I-)的比值为 .[Ksp(AgBr)=5.4×10-13,Ksp(AI)=8.5×10-17].
I.(1)氧族元素位于元素周期表的第
(2)写出氧族元素中含有18个电子的两种氢化物的电子式:
(3)一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L.
①下列能说明反应达到平衡状态的是
A.v(O2)正=2v(SO3)逆
B.气体的平均相对分子质量不变
C.气体的密度不变
D.气体的分子总数不变
②从反应开始到平衡,用SO2的浓度变化表示的反应速率为
③该温度下,此反应的化学平衡常数为
④若向平衡体系中再加入4molSO2和2molO2,化学平衡
Ⅱ.(1)已知:HF(aq)与NaOH( aq)反应的△H=一67.7kJ/mol; HCl(aq)与NaOH(aq)反应的△H=-57.3kJ/mol.则HF(aq)?H+(aq)+F-(aq)△H=
(2)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,先生成沉淀(填化学式),当两种沉淀共存时,c(Br-)与c(I-)的比值为
考点:化学平衡状态的判断,元素周期表的结构及其应用,同一主族内元素性质递变规律与原子结构的关系,反应速率的定量表示方法,化学平衡的影响因素,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:Ⅰ、(1)氧族元素最外层电子数为6,位于元素周期表低ⅥA,包括O、S、Se、Te、Po;
(2)含有18个电子的两种氢化物为H2S,H2O2,都是共价化合物形成共用电子对,据此写出电子式;
(3)①依据平衡标志是正逆反应速率相同,个组分含量保持不变;
②依据反应速率V=
;
③依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
④恒容容器中再加入4molSO2和2molO2,相当于增大压强,平衡正向进行
Ⅱ、(1)HF(aq)与NaOH(aq)反应可分为两步:①HF在水溶液中电离HCN?H++F-;②产生的H+与NaOH(aq)反应;利用盖斯定律进行计算,可得HF在水溶液中电离的反应热;
(2)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,先生成沉淀(填化学式),当两种沉淀共存时,依据溶度积常数计算;
(2)含有18个电子的两种氢化物为H2S,H2O2,都是共价化合物形成共用电子对,据此写出电子式;
(3)①依据平衡标志是正逆反应速率相同,个组分含量保持不变;
②依据反应速率V=
| △c |
| △t |
③依据平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到;
④恒容容器中再加入4molSO2和2molO2,相当于增大压强,平衡正向进行
Ⅱ、(1)HF(aq)与NaOH(aq)反应可分为两步:①HF在水溶液中电离HCN?H++F-;②产生的H+与NaOH(aq)反应;利用盖斯定律进行计算,可得HF在水溶液中电离的反应热;
(2)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,先生成沉淀(填化学式),当两种沉淀共存时,依据溶度积常数计算;
解答:
解:I、(1)氧族元素最外层电子数为6,位于元素周期表低ⅥA,包括O、S、Se、Te、Po;
故答案为:VIA;Se;
(2)含有18个电子的两种氢化物为H2S,H2O2,都是共价化合物形成共用电子对,据此写出电子式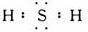
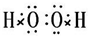 ;
;
故答案为: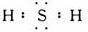
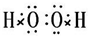 ;
;
(3)①2SO2(g)+O2(g)?2SO3(g),反应是气体体积减少的放热反应;
A.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2v(O2)正=v(SO3)逆,能说明反应达到平衡状态,v(O2)正=2v(SO3)逆不能说明故A错误
B.反应是气体物质的量减少的反应,反应前后气体质量不变,气体的平均相对分子质量不变,说明反应达到平衡状态,故B正确;
C.反应前后气体质量和体积不变,气体的密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应是气体物质的量减少的反应,气体的分子总数不变说明反应达到平衡状态,故D正确;
故答案为:BD;
②一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L,用SO2的浓度变化表示的反应速率=
=0.3mol/L?min;
故答案为:0.3mol/(L?min);
③一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L,依据化学平衡三段式列式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 2 1 0
变化量(mol/L) 0.6 0.3 0.6
平衡量(mol/L) 1.4 0.7 0.6
平衡常数K=
=
=0.26L/mol;
故答案为:0.26L/mol;
④恒容容器中再加入4molSO2和2molO2,相当于增大压强,平衡正向进行,再次达到平衡时SO2的转化率增大;
故答案为:向右;增大;
II.(1)反应的热化学方程式分别为:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ?mol-1…①
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1…②
据盖斯定律,用①-②可得HF电离的热化学方程式为:HF(aq)?H+(aq)+CN-(aq)△H=-67.7kJ?mol-1-(-57.3kJ?mol-1)=-10.4kJ?mol-1,
故答案为:-10.4kJ/mol;
(2)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,碘化银溶度积常数小于溴化银,先生成沉淀AgI,AgBr+I-=AgI+Br-,当两种沉淀共存时,银离子浓度相同,c(Br-)与c(I-)的比值=
=
=6.35×103;
故答案为:AgI,6.35×103;
故答案为:VIA;Se;
(2)含有18个电子的两种氢化物为H2S,H2O2,都是共价化合物形成共用电子对,据此写出电子式
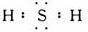
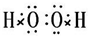 ;
;故答案为:
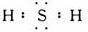
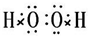 ;
;(3)①2SO2(g)+O2(g)?2SO3(g),反应是气体体积减少的放热反应;
A.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2v(O2)正=v(SO3)逆,能说明反应达到平衡状态,v(O2)正=2v(SO3)逆不能说明故A错误
B.反应是气体物质的量减少的反应,反应前后气体质量不变,气体的平均相对分子质量不变,说明反应达到平衡状态,故B正确;
C.反应前后气体质量和体积不变,气体的密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应是气体物质的量减少的反应,气体的分子总数不变说明反应达到平衡状态,故D正确;
故答案为:BD;
②一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L,用SO2的浓度变化表示的反应速率=
| 0.6mol/L |
| 2min |
故答案为:0.3mol/(L?min);
③一定温度下,在一个容积为2L的密闭容器中充人4mol SO3和2mol O2,发生反应2SO2(g)+O2(g)?2SO3(g);2min后达到平衡,测得容器中SO3的浓度为0.6mol/L,依据化学平衡三段式列式计算:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 2 1 0
变化量(mol/L) 0.6 0.3 0.6
平衡量(mol/L) 1.4 0.7 0.6
平衡常数K=
| c2(SO3) |
| c2(SO2)c(O2) |
| 0.62 |
| 1.42×0.7 |
故答案为:0.26L/mol;
④恒容容器中再加入4molSO2和2molO2,相当于增大压强,平衡正向进行,再次达到平衡时SO2的转化率增大;
故答案为:向右;增大;
II.(1)反应的热化学方程式分别为:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ?mol-1…①
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1…②
据盖斯定律,用①-②可得HF电离的热化学方程式为:HF(aq)?H+(aq)+CN-(aq)△H=-67.7kJ?mol-1-(-57.3kJ?mol-1)=-10.4kJ?mol-1,
故答案为:-10.4kJ/mol;
(2)25℃时,向浓度均为0.1mol/L的NaBr和Nal的混合溶液中逐滴加入AgNO3溶液,碘化银溶度积常数小于溴化银,先生成沉淀AgI,AgBr+I-=AgI+Br-,当两种沉淀共存时,银离子浓度相同,c(Br-)与c(I-)的比值=
| Ksp(AgBr) |
| Ksp(AgI) |
| 5.4×10-13 |
| 8.5×10-17 |
故答案为:AgI,6.35×103;
点评:本题考查了化学平衡、化学反应速率的影响因素分析判断,热化学方程式书写计算,沉淀溶解平衡的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
已知N≡N键的键能是a kJ?mol-1,H-H键的键能是b kJ?mol-1,N-H键的键能是c kJ?mol-1,则N2(g)+3H2(g)?2NH3(g)的△H(kJ?mol-1)为( )
| A、3c-a-b |
| B、a+b-3c |
| C、a+3b-2c |
| D、a+3b-6c |
 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题: